nterleukin 10 (IL-10) is an anti-inflammatory cytokine that plays a critical role in the control of immune responses. However, its mechanisms of action remain poorly understood. Here, we show that IL-10 opposes the switch to the metabolic program induced by inflammatory stimuli in macrophages. Specifically, we show that IL-10 inhibits lipopolysaccharide-induced glucose uptake and glycolysis and promotes oxidative phosphorylation. Furthermore, IL-10 suppresses mammalian target of rapamycin (mTOR) activity through the induction of an mTOR inhibitor, DDIT4. Consequently, IL-10 promotes mitophagy that eliminates dysfunctional mitochondria characterized by low membrane potential and a high level of reactive oxygen species. In the absence of IL-10 signaling, macrophages accumulate damaged mitochondria in a mouse model of colitis and inflammatory bowel disease patients, and this results in dysregulated activation of the NLRP3 inflammasome and production of IL-1β.
白细胞介素10 (IL-10) 是一种抗炎细胞因子,在控制免疫反应中发挥着关键作用。然而,其作用机制仍知之甚少。在这里,我们发现 IL-10会阻止巨噬细胞中炎症刺激诱导的代谢程序的转变。具体来说,我们发现 IL-10抑制脂多糖诱导的葡萄糖摄取和糖酵解,并促进氧化磷酸化。此外,IL-10通过诱导 mTOR抑制剂DDIT4 来抑制哺乳动物雷帕霉素靶点 (mTOR) 活性。因此,IL-10促进线粒体自噬,从而消除以低膜电位和高水平活性氧为特征的功能失调的线粒体。在缺乏IL-10信号传导的情况下,结肠炎和炎症性肠病患者的小鼠模型中,巨噬细胞会积累受损的线粒体,这会导致NLRP3炎症小体的激活失调和IL-1β的产生。
IL-10 缺陷型巨噬细胞在 LPS 刺激后表现出代谢特征改变
作者分析了 Il10–/– 骨髓源性巨噬细胞 (BMDM),了解 LPS 刺激后细胞外酸化率 (ECAR) 和线粒体耗氧率 (OCR) 的变化,分别作为糖酵解和 OXPHOS 的指标。与野生型 (WT) BMDM 相比,Il10–/– BMDM 变得更加糖酵解(即,具有更高的基础 ECAR),但“氧化”程度更低(即,具有更低的基础 OCR)(图 1、A 和 B)。Il10–/– 细胞中 OXPHOS 的减少并不是由于一氧化氮 (NO) 的产生,因为用诱导型一氧化氮合酶抑制剂治疗未能挽救该表型。然而,添加外源性 IL-10 可恢复 Il10–/– 细胞中的 WT 表型(图 1,A 和 B),而用针对 IL-10R α 亚基 (IL-10Rα) 的封闭抗体处理 WT BMDM 导致 ECAR 和 OCR 的变化与 Il10–/– 细胞相似,表明 IL-10 在巨噬细胞中具有自分泌作用。腹腔注射 LPS 的 Il10-/- 小鼠的脾巨噬细胞中也观察到过度的糖酵解。接下来,作者通过测定用寡霉素[三磷酸腺苷 (ATP) 合酶抑制剂]、氰化物对三氟甲氧基苯腙 (FCCP)(H+ 离子载体)和鱼藤酮连续处理细胞期间 OCR 的实时变化来评估线粒体的功能概况 (电子传递链的抑制剂)(图1C)。与 WT BMDM 相比,LPS 刺激后 Il10–/– BMDM 中缺乏外源性 IL-10,导致最大呼吸能力 (MRC) 较低(图 1、C 和 D)。这些结果表明,LPS 刺激后在 Il10–/– BMDM 中观察到的基础 OCR 降低可能是由于线粒体适应性的丧失,如 MRC 降低所表明的。与这一想法一致,LPS 刺激后 Il10–/– BMDM 中的基础细胞 ATP 水平也降低了。
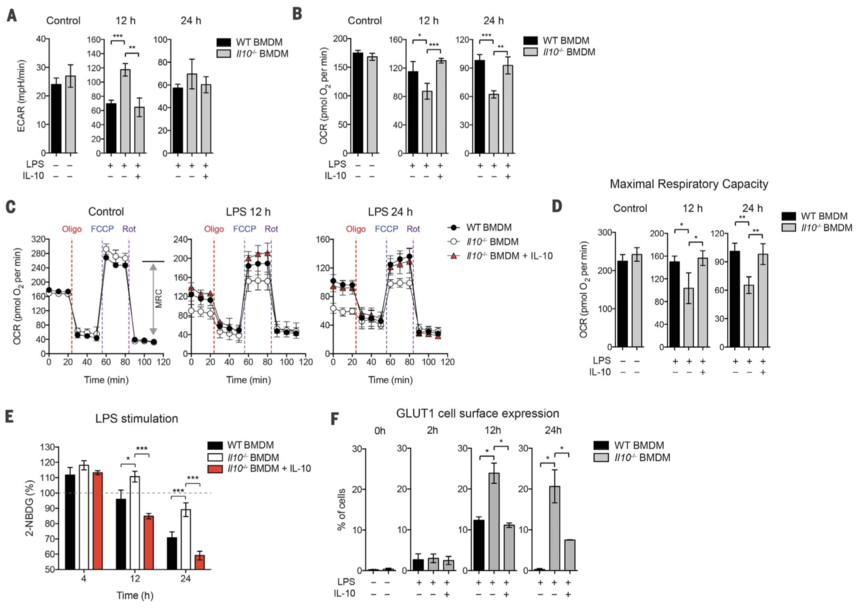
图1
接下来作者思考 IL-10 对糖酵解的抑制是否是由于糖酵解通量的抑制。与之前的研究一致,在 WT BMDM 中,葡萄糖摄取量在 LPS 刺激后 2 小时内增加并达到最大值,并在 12 小时后下降。4 小时时,在 LPS 刺激的 Il10–/– BMDM 中也观察到了葡萄糖摄取(图 1E)。然而,在没有外源IL-10的情况下,LPS刺激12小时后,Il10–/–细胞的葡萄糖摄取维持在较高水平(图1E),这表明IL-10对葡萄糖摄取具有抑制作用。
葡萄糖转运蛋白 GLUT1 在 LPS 刺激期间巨噬细胞的葡萄糖摄取中发挥着重要作用。事实上,作者的 RNA 测序 (RNA-seq) 数据显示 BMDM 在稳定状态下主要表达 Glut1。然而,Glut1 的表达不受 IL-10 的影响。因此,作者思考 IL-10 是否抑制 GLUT1 从细胞内囊泡到细胞表面的易位,这是促进细胞摄取葡萄糖的关键步骤。为了测试这一点,作者用抗体追踪了 GLUT1 的细胞定位,并通过免疫荧光和 ImageStream 分析将其可视化。两项分析均表明,GLUT1 在稳态时主要定位于细胞内囊泡,但在 LPS 刺激后易位至质膜(图 1F)。请注意,外源性 IL-10 抑制了 Il10–/– BMDM 中的 GLUT1 易位(图 1F)。此外,Il10–/– BMDMs 中的 RNA-seq 分析还表明,IL-10 抑制糖酵解途径中编码酶的基因表达,包括 Hk1、Hk3、Pfkp 和 Eno2。总之,这些数据表明 IL-10 通过调节 GLUT1 易位和糖酵解酶的基因表达来抑制糖酵解通量。
为了研究 Il10–/– BMDM 中上述线粒体代谢谱的改变是否是由线粒体功能异常引起的,作者首先用 MitoTracker Green 对细胞进行染色,以检测总线粒体含量,而不考虑线粒体膜电位 (Δψm),并发现 Il10–/ – 与 WT 巨噬细胞相比,LPS 刺激后 BMDM 线粒体质量增加(图 2A)。这并不是由于细胞大小增加,因为 Il10–/– 细胞的大小与 WT 细胞相似,而是与流式细胞术测量的侧向散射 (SSC) 信号反映的更大的细胞内复杂性相关。然后作者假设 Il10–/– 细胞中线粒体质量的增加可能是由于功能障碍线粒体的积累和 Δψm 的损失所致。为了测试这一点,作者结合使用 MitoTracker Green(Δψm 独立的线粒体染色剂)和 MitoTracker Red(Δψm 依赖的线粒体染色剂)来区分呼吸线粒体和功能障碍线粒体,并且作者观察到功能障碍线粒体的增加 (MitoTracker) LPS 刺激的 Il10–/– BMDM 中(绿色+高,MitoTracker 红色+低)(图 2B)。这与使用四甲基罗丹明甲酯染色观察到的 Δψm 损失一致。这些数据表明,在没有 IL-10 的情况下,LPS 刺激期间会发生功能障碍线粒体的积累。
已知 Δψm 的损失与线粒体 ROS 的积累有关 。因此,作者检查了 Il10–/– BMDM 中 Δψmlow 线粒体的积累是否与线粒体 ROS 的产生相关。为了评估线粒体中的 ROS 水平,作者使用线粒体特异性 ROS 指示剂 MitoSOX 来选择性检测活细胞线粒体中的超氧化物。作者发现,在没有外源性 IL-10 的情况下,LPS 刺激的 Il10–/– 巨噬细胞中 MitoSOX 荧光增强(图 2C),并且与 MitoTracker Green 染色所示的线粒体总质量相关(图 2D),这些发现表明 IL-10 的缺失会导致积累的线粒体产生 ROS。Il10–/– 细胞中产生 ROS 的线粒体的积累也通过使用两种荧光染料的活细胞成像进行可视化(图 2E)。此外,Il10-/-巨噬细胞中ROS的产生是线粒体起源的,因为它可以通过线粒体复合物II抑制剂的处理来阻断。
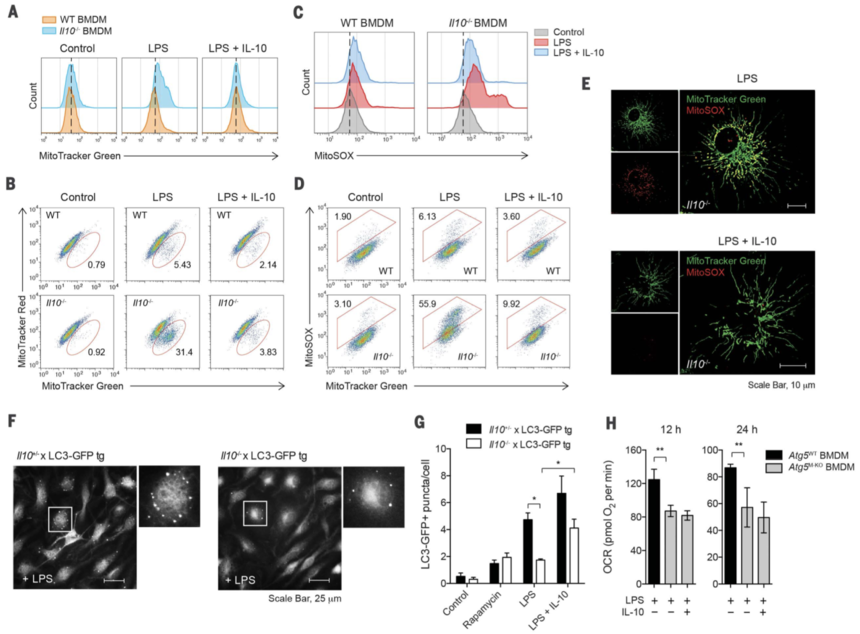
图2
作者假设功能失调和产生 ROS 的线粒体的积累可能是 LPS 刺激后 Il10–/– 细胞线粒体自噬受损的结果。为了检测线粒体自噬,作者在 LC3-GFP 转基因 (tg) 小鼠产生的 BMDM 中过表达线粒体靶向融合蛋白 (Mito-DsRed),这些小鼠表达绿色荧光蛋白 (GFP) 标记的 LC3,并观察到 LC3-GFP 的募集增加 LPS 刺激的细胞中的 Mito-DsRed+ 线粒体表明在 LPS 刺激期间诱导了线粒体自噬。为了更准确地确定 IL-10 在线粒体自噬中的作用,作者将 LC3-GFP 转基因小鼠与 Il10–/– 小鼠杂交,产生了 Il10–/– LC3-GFP BMDM。通过测量 LPS 刺激后 LC3-GFP 斑点的形成来评估自噬,如图 2F 所示。正如预期的那样,无论 IL-10 是否缺乏,带有 LC3-GFP 的 Il10+/– 和 Il10–/– BMDM 在用 mTOR 抑制剂雷帕霉素处理后,LC3 斑点的形成增加,已知雷帕霉素会诱导自噬(图 2G)。然而,在没有外源性IL-10的情况下,与对照细胞(即Il10+/–)相比,LPS刺激后Il10–/– LC3-GFP细胞的LC3斑点形成显着降低(图2G),这表明诱导 LPS刺激后巨噬细胞中IL-10的线粒体自噬。与这一想法一致,缺乏 Atg5 的 BMDM 在 OCR 中也表现出显着改变的代谢特征(图 2H)。然而,与 Il10–/– BMDM 不同,添加外源 IL-10 未能恢复 Atg5 缺陷细胞中的 WT 表型(图 2H),这表明 IL-10 对线粒体功能的影响在很大程度上(但可能不完全) 是自噬依赖性的。
IL-10 通过抑制 mTOR 维持线粒体完整性和功能
mTOR 是关键的代谢调节因子,mTORC1 的激活可控制葡萄糖和脂质代谢并抑制自噬。鉴于观察到 IL-10 对线粒体自噬的影响,作者检查了 IL-10 是否调节 mTORC1 通路的活性。为了支持 mTORC1 可能协调巨噬细胞激活过程中代谢变化的观点,用 LPS 刺激 WT BMDM 导致 mTORC1 激活高于基础水平,如 S6K、S6 和 4E-BP1 等下游靶点磷酸化增加所表明的那样, 2小时内达到最高水平,6小时后被强烈抑制(图3A)。这种严格调节的 mTORC1 激活在 Il10–/– BMDM 中受到损害,在 LPS 刺激期间观察到更高且更长的激活(图 3A)。向这些细胞中添加外源IL-10再次能够恢复在WT细胞中观察到的调节(图3A)。此外,在缺乏 STAT3(IL-10R 信号下游的关键转录因子)的 BMDM 中也观察到 mTORC1 激活时间延长,并且通过添加外源性 IL-10 无法挽救这种情况(图 3B)。这些数据表明 IL-10 通过 STAT3 信号传导抑制 mTORC1 激活。此外,IL-10 抑制 Akt 靶点富含脯氨酸的 Akt 底物 40 kDa (PRAS40) 和 mTOR 的磷酸化,并且与之前的报告一致,IL-10 增加腺苷 5'-单磷酸激活激酶的磷酸化 (AMPK)。
接下来,作者测试了 IL-10 对 mTOR 的抑制是否负责在 LPS 刺激期间维持线粒体完整性和功能,否则可能会导致功能障碍线粒体的积累,如 Il10–/– BMDM 中所见。作者用雷帕霉素处理 Il10–/– BMDM,以在 LPS 刺激期间直接抑制 mTOR,并评估其线粒体含量和耗氧量。雷帕霉素治疗的效果与外源性 IL-10 相似,可抑制功能障碍线粒体的积累,导致 Δψm 损失(图 3C),并增强 Il10-/- 细胞中的基础呼吸和 MRC(图 3、D 和 E)。此外,雷帕霉素治疗还降低了 LPS 刺激期间 Il10–/– 细胞中的 ECAR,这表明 IL-10 通过抑制 mTOR 抑制糖酵解,尽管 IL-10 也可能通过未知过程调节 GLUT1 易位。
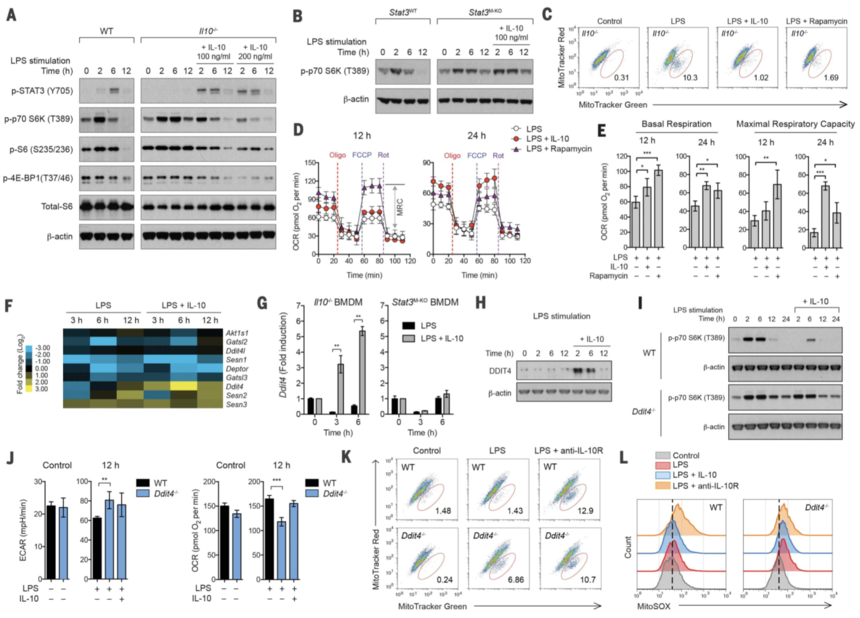
图3
接下来作者试图确定 IL-10 如何抑制 mTOR 信号传导。因为抑制是 STAT3 依赖性的(图 3B),所以该机制应该需要转录。因此,作者进行了RNA-seq分析,并检查IL-10是否在转录上调节代谢途径,从而导致mTOR信号传导的抑制。值得注意的是,我们发现 IL-10 调节已知参与 mTORC1 上游信号传导的基因子集。这些基因的调节可能对抑制 mTOR 信号传导产生集体影响。然而,LPS 刺激前后 BMDM 中其基因产物的丰富且稳定的蛋白质水平使作者假设 IL-10 对 mTOR 信号传导的抑制可能是通过负性抑制的主动抑制来介导的。监管机构。因此,作者关注已知的 mTOR 信号传导负调节因子并检查它们的基因表达。在这些基因中,作者发现 Ddit4 在 LPS 刺激期间被 IL-10 强烈诱导(图 3,F 和 G)。这种上调也在蛋白质水平上得到证实(图3H),它需要转录因子STAT3(图3G),但不需要缺氧诱导因子HIF-1α(数据未显示),这是Ddit4的已知应对缺氧调节因子。
为了评估 DDIT4 在巨噬细胞中的作用,作者从 Ddit4–/– 小鼠中产生 BMDM,并用 LPS 刺激它们。缺乏 DDIT4 的细胞在 LPS 刺激过程中 mTORC1 激活时间延长,这种表型与作者在 Il10–/– BMDM 中观察到的表型类似。然而,与WT细胞不同,外源IL-10处理未能抑制Ddit4–/–细胞中mTORC1的激活(图3I),这表明IL-10对mTOR信号传导的抑制是DDIT4依赖性的。此外,与缺乏 IL-10 信号传导的细胞(即用 IL-10Rα 阻断抗体处理)类似,Ddit4–/– BMDM 在 ECAR 和 OCR 方面表现出显着改变(图 3J),并积累了功能失调的线粒体,导致线粒体功能丧失。Δψm 以及 LPS 刺激后 ROS 产生增强(图 3,K 和 L)。外源性 IL-10 治疗对逆转表型的影响很小,这表明 DDIT4 是 IL-10 信号转导的关键靶标。总之,这些观察结果表明,IL-10 通过 DDIT4 对 mTOR 信号传导的抑制在 LPS 刺激后巨噬细胞的线粒体清除中起着重要作用。与这个想法一致,在 Il10–/– BMDM 中过度表达 DDIT4 能够恢复 mTOR 信号传导的抑制和受损线粒体的积累。
IL-10 通过抑制 mTOR 负向调节炎症小体激活
接下来作者评估了 IL-10 在炎症反应中代谢控制的作用。线粒体已成为信号细胞器,有助于某些先天免疫途径,包括炎性体激活和 RIG-I 样受体 (RLR) 信号传导。作者利用双信号模型进行 NLRP3 炎症小体激活,其中 BMDM 用 LPS 引发(信号 1),然后用 ATP 刺激(信号 2)。作者发现 Il10–/– 和 Ddit4–/– BMDM 均表现出增强的 caspase-1 裂解,并且用 IL-10 处理 Il10–/– 细胞(而非 Ddit4–/– 细胞)导致 caspase-1 裂解最小化( 图 4A),表明 IL-10 通过诱导 DDIT4 抑制 caspase-1 依赖性炎症小体激活。即使在没有信号 2(即 ATP)的情况下,在缺乏 IL-10 或 STAT3 的细胞中用 LPS 刺激也足以触发 IL-1β 分泌,否则在 WT 细胞中分泌量极小(图 4,B 和 D)。IL-1β的分泌是caspase-1依赖性的(图4B),表明Il10–/– BMDMs中IL-1β的分泌是由于炎症小体的激活。此外,IL-10 抑制炎症小体激活,与 Nlrp3 转录的任何影响无关,因为 NLRP3 的过表达并不能克服抑制作用。然后作者假设 Il10–/– 细胞中线粒体 ROS 产生的增强可能作为炎症小体激活的内源信号。为了支持这一点,用抗氧化剂 N-乙酰半胱氨酸 (NAC) 或线粒体 ROS 抑制剂 Mito-TEMPO 处理 Il10–/– 细胞能够抑制 IL-1β 分泌(图 4C)。在过度表达 pro-IL-1β 的 Il10–/– 细胞中,也证实了 ROS 抑制剂对炎症小体激活的影响,而不是对 pro–IL-1β 表达的影响,其中 IL-1β 分泌受到抗氧化剂的抑制。与此一致的是,Mito-TEMPO 在 LPS 刺激期间对 Il10-/- 细胞中 pro-IL-1β 的基因表达没有影响。
接下来作者测试了雷帕霉素、自噬抑制剂 3-MA 或自噬激活剂 AICAR 或 DDIT4 过度表达的治疗是否对 Il10–/– 细胞中异常的 IL-1β 分泌有影响。在缺乏 IL-10 或 STAT3 的细胞(图 4D)或过表达 pro-IL-1β 的 Il10–/– 细胞(图 4D)中,IL-1β 分泌被雷帕霉素和 AICAR 抑制,但被 3-MA 增强。已知自噬可抑制炎症小体激活。总的来说,这些数据表明 IL-10 通过抑制 mTOR 诱导线粒体自噬有助于抑制炎症小体激活。与此一致的是,在 Atg5 缺陷的 BMDM 中,IL-10 抑制 IL-1β 分泌的作用显着降低(图 4E)。由于自噬缺陷可导致 ROS 依赖性 RLR 信号传导放大,因此作者还测试了 IL-10 是否抑制 RLR 信号传导。事实上,用与 lipofectamine 复合的聚 (I:C) 刺激的 Il10–/– BMDM 表现出增强的 I 型干扰素反应,而用 NAC 或外源性 IL-10 治疗可抑制增强的反应。
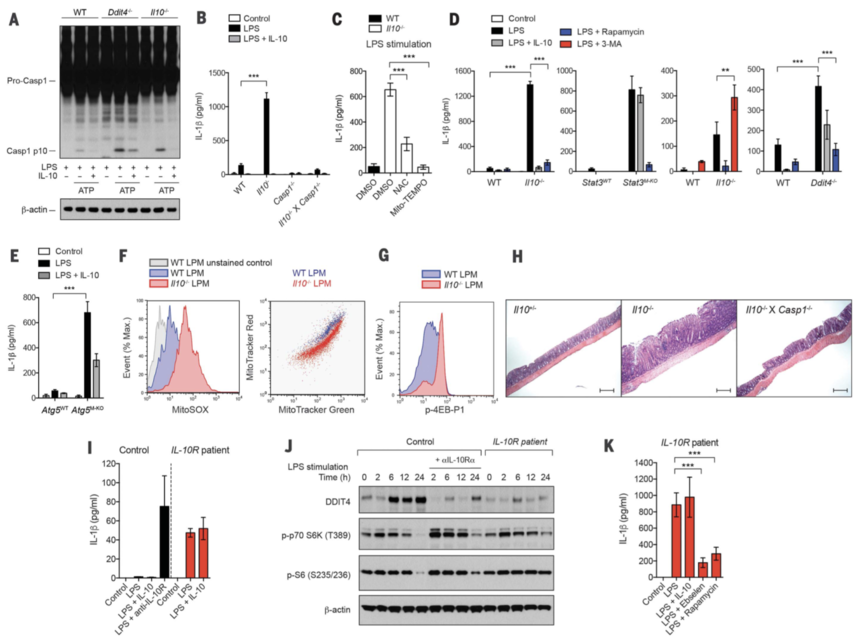
图4
IL-10 缺陷小鼠和 IL-10R 缺陷 IBD 患者中巨噬细胞炎性体的异常激活
作者之前已经表明,肠道细菌通过肠道巨噬细胞中的 MyD88 进行感知,会导致 IL-10 缺陷小鼠患结肠炎。为了在体内测试我们当前的模型,作者从患有严重结肠炎的 Il10–/– 小鼠中分离了结肠固有层细胞,并评估了固有层巨噬细胞 (LPM) 中的线粒体含量和 mTOR 信号传导。与 LPS 刺激的 Il10–/– BMDM 类似,来自 Il10–/– 小鼠的 LPM 具有更高的线粒体 ROS,积累线粒体并损失 Δψm(图 4F),并且 mTORC1 的激活增加(图 4G);这些发现表明,在缺乏 IL-10 的情况下,LPM 中 mTOR 信号传导增加导致线粒体 ROS 产生,通过炎症小体激活导致结肠炎的发生。与这一观点一致,与仅缺乏 IL-10 的小鼠相比,同时缺乏 IL-10 和 caspase-1 的小鼠结肠炎的病理学显着减轻(图 4H)。最后,作者发现来自IL-10R基因无效突变的IBD患者的单核细胞衍生的巨噬细胞也表现出IL-1β的异常分泌(图4I)、DDIT4表达减少和mTORC1激活时间延长(图4J)。此外,抗氧化剂或雷帕霉素分别抑制ROS或mTOR信号传导,抑制这些细胞中IL-1β的分泌(图4K)。总的来说,这些数据表明 IL-10 至少部分通过消除功能失调的线粒体抑制巨噬细胞中的 mTOR 信号传导和炎症小体激活来预防结肠炎的发生。















