找到核糖体相关的GO通路和其中富集的331个基因,根据DepMap上的RNAi/CRISPR screening 数据选出了251个核糖体相关的基因(图1B)。接下来,作者根据ssGSEA开发了新算法(图1C)。上述251个基因为关键基因,非核糖体相关的基因为背景基因。将关键基因按表达量排序,然后进行富集打分。为了检验这个打分方法,作者将TCGA-BRCA和CPTAC中的150个样本用这个方法进行打分,然后用得到的评分与RRP1,FBL,NOP56,USP36等可以用于评价核糖体合成活性的基因的表达量做相关性分析。
通过图1D可以看出,RRP1的表达量与评分呈正相关。通过图1E可以看出,核糖体生成评分高的样本FBL表达量也更高。癌症治疗药物5-氟尿嘧啶是一种核糖体合成抑制剂,作者使用接受5-氟尿嘧啶治疗的患者样本的单细胞转录组数据对细胞进行核糖体生成评分,发现治疗剂量越高,评分越低(图1F)。


图1
作者对TCGA/GTEx中的33种不同癌症类型的样本进行评分,发现不同组织的核糖体生成活跃程度也是不同的(图2A)。DLDC核糖体生成活跃程度最高,而KIRC最低。在大多数癌症类型中,肿瘤组织的评分高于正常组织(图2B)。对单细胞转录组数据的评分也证明了这一点(图2C-E)。
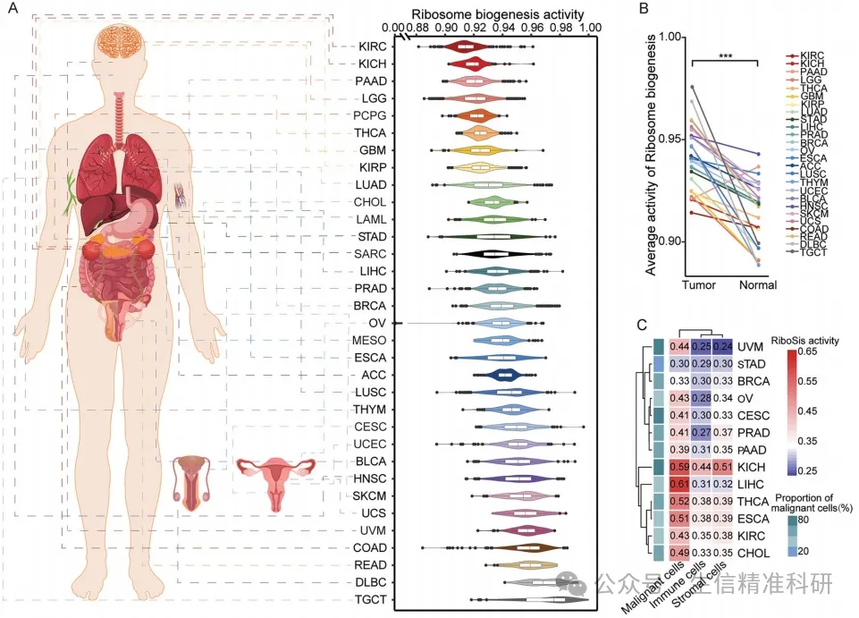
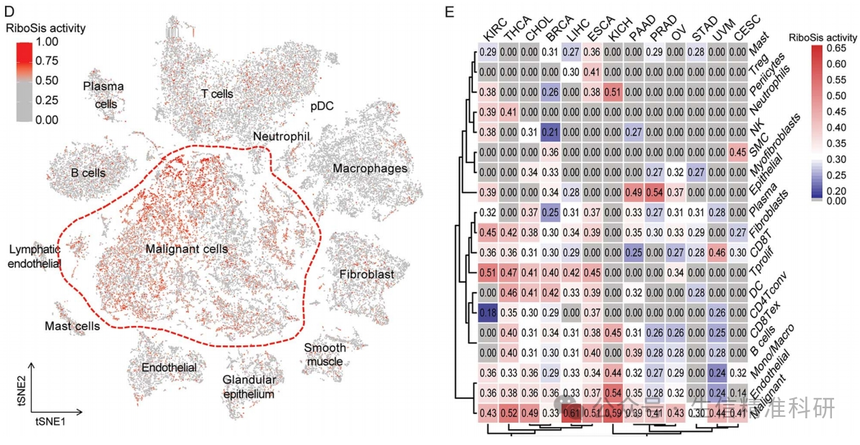
图二
接下来,作者探究了核糖体生成异常活跃与肿瘤诊断与预后的关系。通过AUC曲线可言看出,核糖体生成的活跃程度可以明显区分肿瘤组织和非肿瘤组织(图3A)。通过预后分析发现,在所有癌症中,核糖体生成评分高的病人生存率都低于评分低的病人(图3B)。其中,LUSC,PRAD,HNSC,LUAD这几种癌症表现最明显(图3C)。肿瘤样本中核糖体生成相关的基因明显上调(图3D)。不同类型的癌症表现出癌种特异性的核糖体生成相关基因失调模式。其中,229个核糖体生成相关基因(69%)在所有类型的持续上调,而只有15个核糖体生成相关基因(5%)持续下调(图3E)。
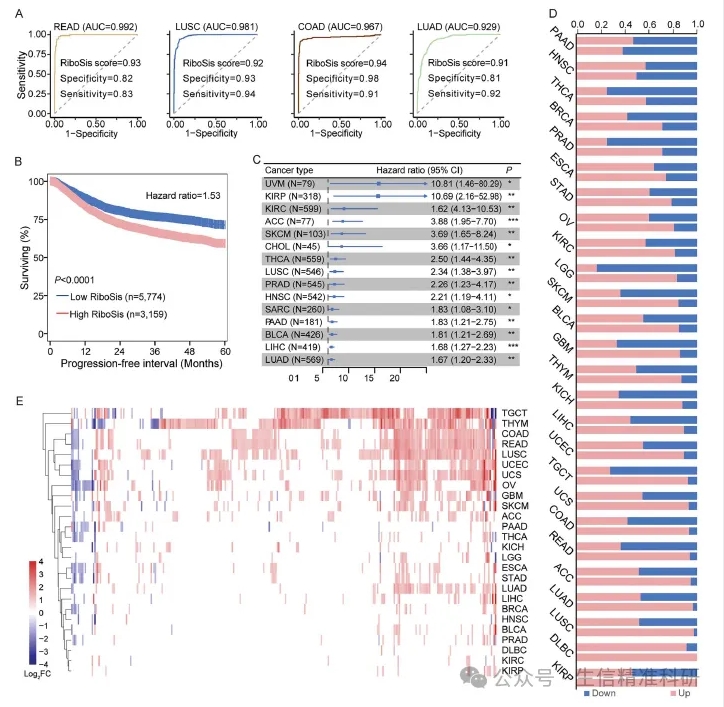
图三
为了探索核糖体生成相关的DNA水平的改变,作者进行了CNV分析。总体而言,在人类癌症中观察到核糖体生成相关基因的CNV比例高于SNV,尤其是在PCPG、TGCT和(UVM)中(图4A,B)。
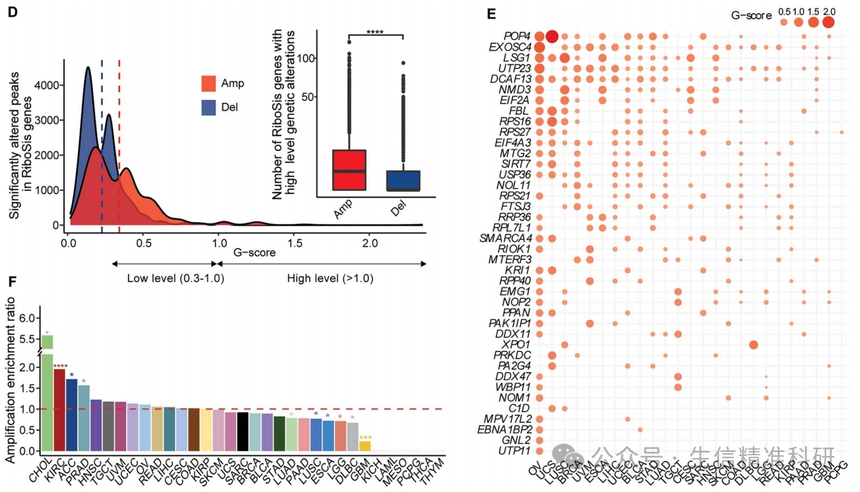
作者使用GISTIC2鉴定的全癌症水平上显著改变的峰值来评核糖体生成相关基因的CNV(q < 0.25;图4C),发现糖体生成相关的基因中经常出现高水平的CNV(图4D),并且CHOL、KIRC、ACC和PRAD显示出显著的CNV峰值(图4F)。作者找到了40个在不同癌症中反复扩增的RiboSis基因(G-score>0.5;图4E),其中包括XPO1。综合这些结果表明,反复扩增的RiboSis基因在人类癌症中起着重要作用。
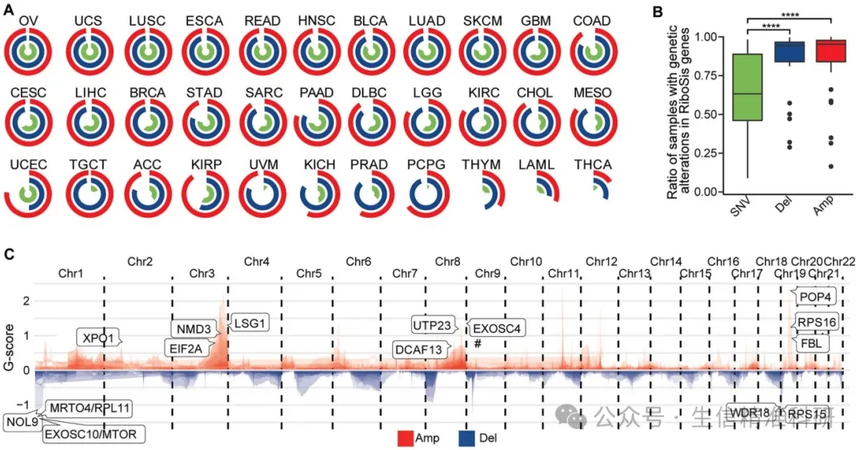
图四
目前只有两个核糖体生成相关基因(XPO1和mTOR)作为治疗靶点,大量对于癌症生长至关重要的核糖体生成相关基因缺乏充分研究,没有被开发为药物靶点,但具有很大的潜力(图5A)。在恶性肿瘤中,基因频繁发生的改变构成了癌症治疗的脆弱性,而反复发生的改变基因更有可能成为潜在的治疗靶点。
根据CNV和SNV分析,共有128个核糖体生成相关基因被确定为潜在的治疗靶点(图5B)。其中一些基因,如DCAF13、EXOSC4和UTP23,扩增频率都比XPO1更高(图4E)。TP53是全癌症水平上最常见的SNV(图5B)。在TP53突变的病人中,核糖体生成通路的活性显著增加(图5C),并且核糖体生成活跃度高与非TP53突变的LUSC患者预后不良相关(图5D)。将这些核糖体生成相关基因的基因组测序数据与转录组数据叠加,然后按照表达量和CNV对这些基因进行排序,选出每种癌症中排名前10的基因(包括BMS1和XRCC5)与各种类型的癌症做网络图,可以看出这些基因与很多癌症有很大关联,是具有潜力的靶点(图5E)。
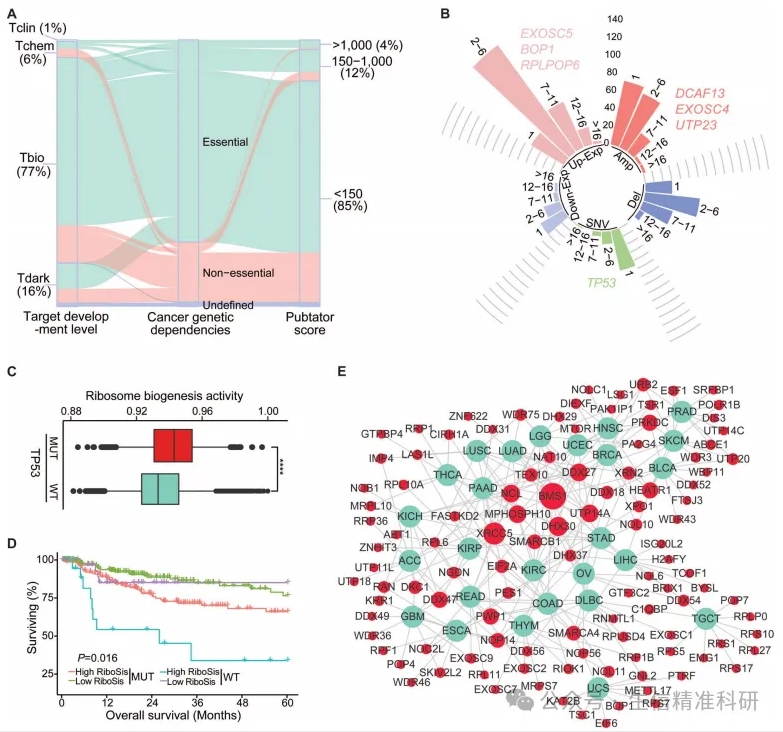
图五
作者从已知的抗癌药物中筛选可能通过抑制核糖体生成来治疗癌症的药物。首先,作者根据来自TCGA的 9173名患者的信息和转录组数据,利用机器学习预测了这些患者对367种化合物的药物反应(图6A),找出与核糖体生成基因表达量高度相关(|r| > 0.8,P < 0.05)的药物。核糖体生成基因表达大多与患者的药物反应呈负相关,即核糖体生成基因高表达与患者药物敏感性增加相关,特别是在DLBC和THYM中(图6B)。将与药物反应呈负关联的核糖体生成基因进行功能富集分析,并观察到核糖体合成的每个步骤与不同癌症类型中药物的靶标通路有广泛相关(图6C)。
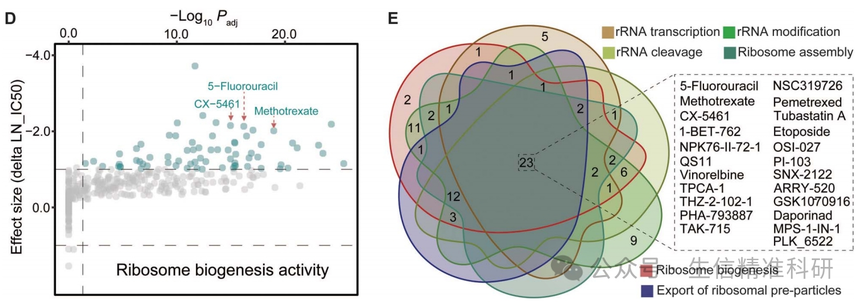
作者利用CCLE的表达数据和GDSC的药物敏感性数据对核糖体生成活性和每种药物的IC50进行了关联分析,发现核糖体生成活性评分更高的癌细胞对其中65种药物更敏感(图6D)。作者对核糖体生成的五个阶段的药物反应差异进行分析,对不同阶段的敏感药物取交集,发现有23种药物在所有阶段中出现(图6E)。这些药物包括甲氨蝶呤、5-氟尿嘧啶和CX-5461等已知具有抑制核糖体生成作用的化合物。因此,这些数据为重新利用临床批准化合物通过抑制核糖体生成来杀死恶性细胞提供了宝贵的资源。
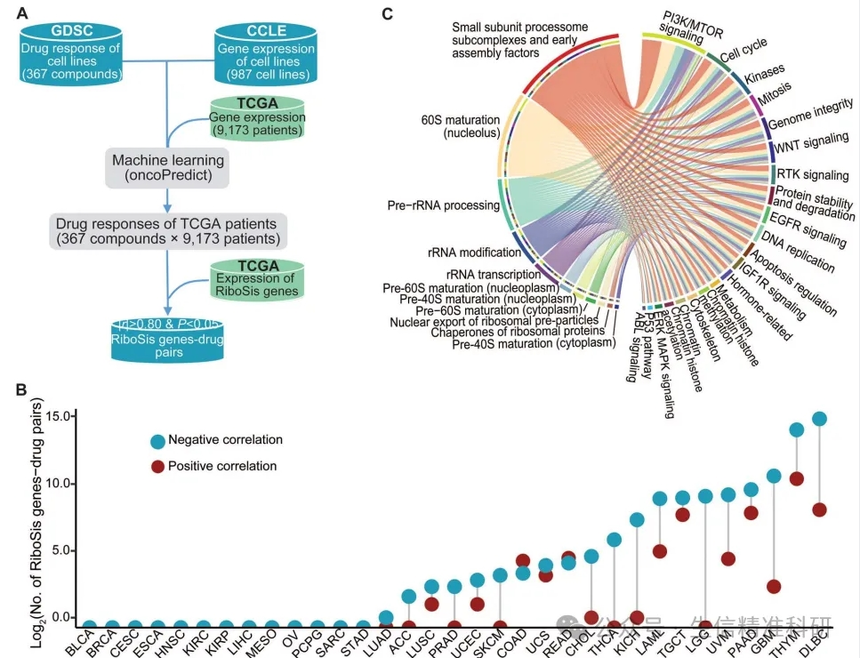
图六