|
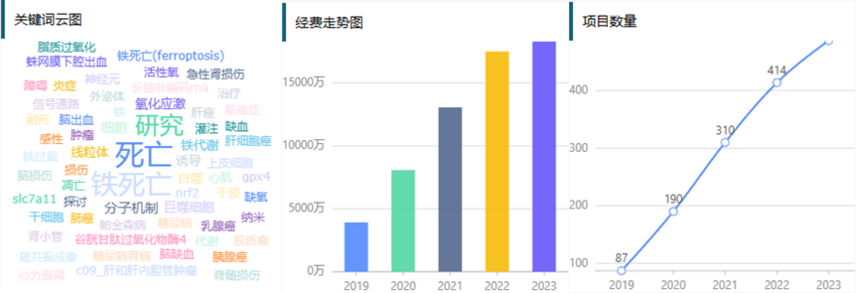
文献分享 | IF=15.9,暨南大学团队揭示中脑多巴胺氧化将谷胱甘肽过氧化物酶4的泛素化与多巴胺能神经元的铁死亡之间的联系在细胞的各式花样死法中,“铁死亡(ferroptosis)”作为一种经典的死亡方式一直备受关注。2023年中标的数量约420项,这个领域也已连续多年稳居热榜。目前铁死亡方向基础研究类文章已经很多,要想创新难度较大,但是宝子们不要怕,今天就带大家从一篇文献中学习一个还不错的课题申报思路。 这篇文献是由暨南大学何蓉蓉、张力、焦根龙及段文君共同通讯在Journal of Clinical Investigation上发表的题为“Midbrain dopamine oxidation links ubiquitination of glutathione peroxidase 4 to ferroptosis of dopaminergic neurons”的研究论文,该研究揭示了中脑多巴胺氧化将谷胱甘肽过氧化物酶4的泛素化与多巴胺能神经元的铁死亡之间的联系。 l题目:中脑多巴胺氧化将谷胱甘肽过氧化物酶4的泛素化与多巴胺能神经元的铁死亡联系起来 l杂志:Journal of Clinical Investigation l影响因子:IF=15.9 l发表时间:2023年7月 研究概述 帕金森病(PD)是一种神经退行性疾病,其特征是中脑多巴胺能神经元逐渐丧失,并伴有α-突触核蛋白的聚集。氧化损伤与PD相关,尽管其机制仍不十分确定。本研究中作者证明了在帕金森病小鼠模型中,过氧化磷脂的积累和抗氧化酶谷胱甘肽过氧化物酶4(GPX4)的损失,是中脑多巴胺能神经元易感和进行性运动功能障碍的原因;还发现了一种降解机制,其中铁诱导的多巴胺氧化修饰了GPX4,从而使其易于通过泛素-蛋白酶体途径降解。本研究揭示了在帕金森病发病过程中多巴胺能神经元变性的一种新途径:由多巴胺诱导的抗氧化剂GPX4活性的丧失而导致。
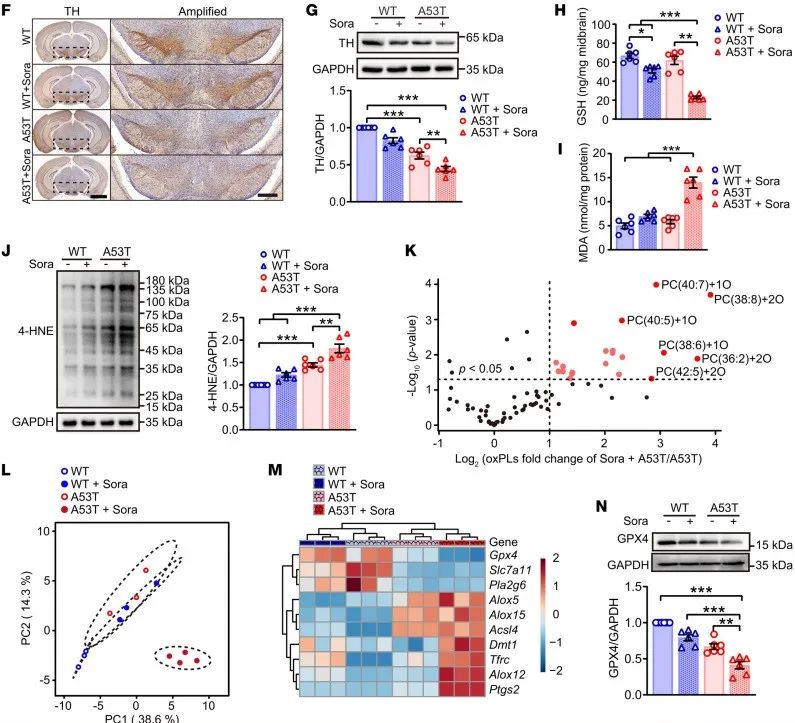
主要结果 1. 帕金森病中磷脂过氧化导致多巴胺能神经元的丧失 作者发现过氧化脂质与α-synuclein直接相关,α-synuclein的表达可呈时间依赖性增加4HNE的堆积。利用基于LC-MS/MS的氧化磷脂组学,发现α-synuclein过表达的PD模型小鼠中脑的磷脂的特征明显区别于WT小鼠,火山图分析发现磷脂过氧化产物显著增多。氧化脂质清除剂Fer-1能明显缓解应激加剧的爬杆和转棒等PD行为损伤。 同时,细胞中的铁死亡抑制基因GPX4明显减少,促进铁死亡的铁转运蛋白TFR1(TFRC)明显增多。
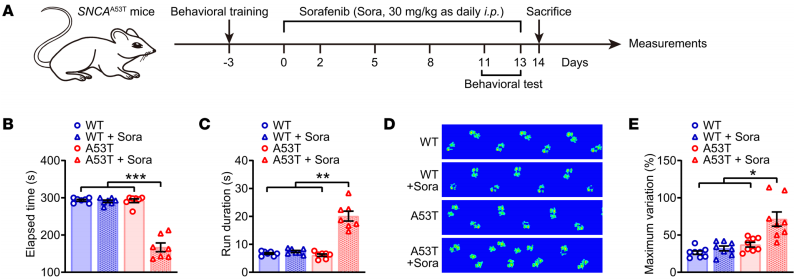
图1 帕金森病中磷脂过氧化导致多巴胺能神经元的丧失 2. 高α-突触核蛋白会增加脂质氧化,从而导致铁死亡 接着作者研究了索拉非尼(一种用于治疗癌症的药物)对体内α-突触核蛋白相关脂质氧化应激的影响。行为学数据显示,索拉非尼增加了A53T小鼠患帕金森病的可能性,表现为协调能力受损和步态紊乱;索拉非尼还恶化了与帕金森病相关的病理现象,如黑质TH水平降低和纹状体DA代谢障碍。α-突触核蛋白的聚集水平并未受到影响,这表明脂质过氧化加速增加了A53T小鼠对帕金森病的易感性。 体外实验表明,α-突触核蛋白会引发脂质过氧化,而索拉非尼会进一步加剧脂质过氧化。磷脂谱分析显示了这些动物的不同模式,表明磷脂过氧化产物的积累。此外,索拉非尼处理的动物体内GPX4(一种参与防止脂质过氧化的关键酶)的表达受到抑制。这些研究结果表明,SNCA的过度表达会通过降低GPX4活性的机制加速铁死亡。
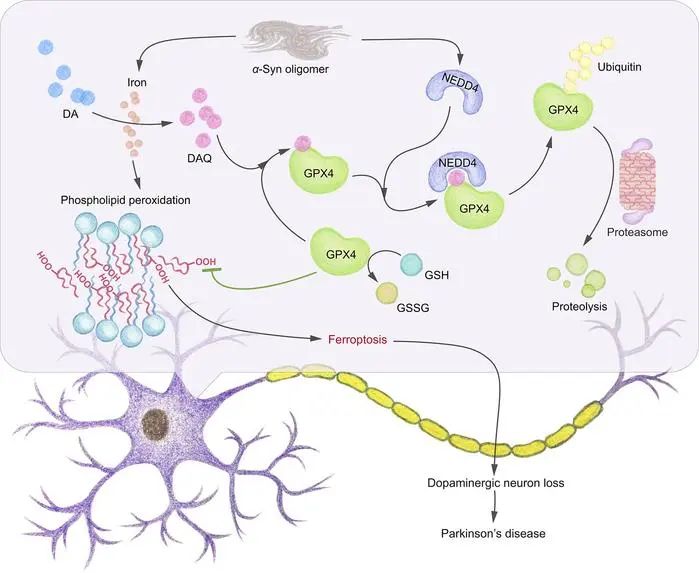
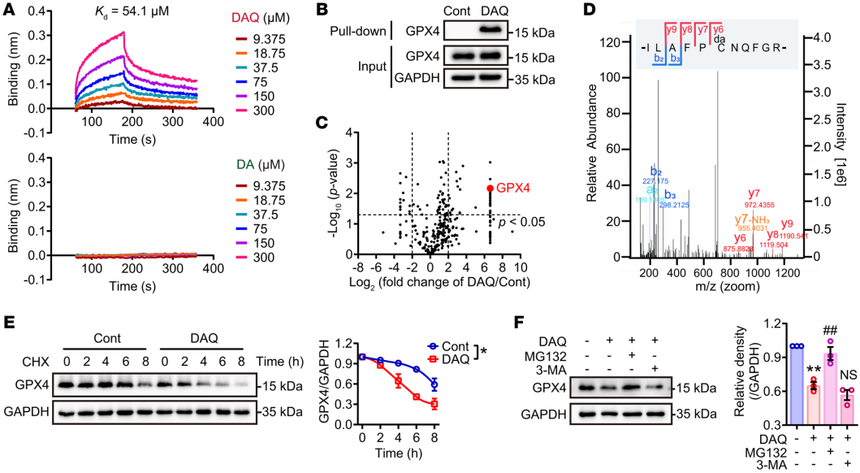
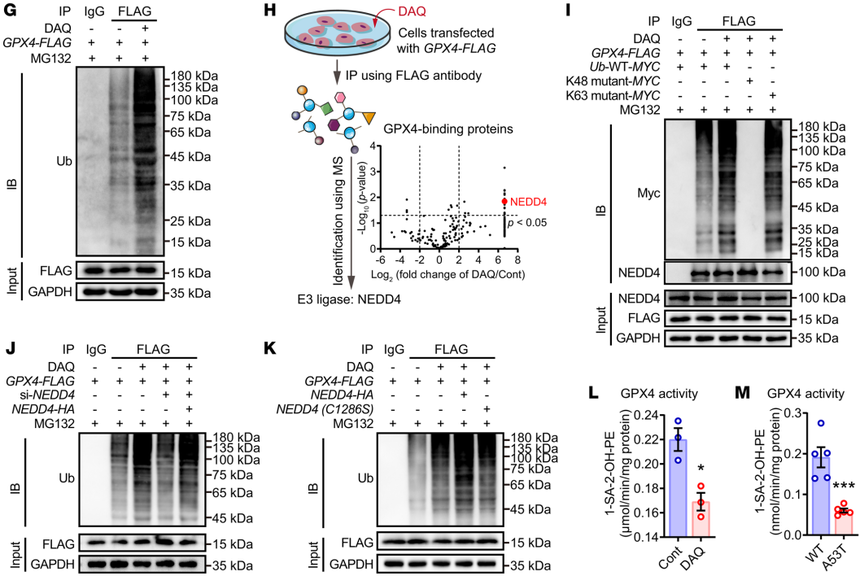
图2 磷脂过氧化与铁死亡相关帕金森综合征有关 3. DAQ修饰通过NEDD4介导的泛素蛋白酶途径诱导GPX4蛋白降解 作者进一步采用pull down、蛋白组学和位点分析等方法,发现DAQ的细胞毒性可能与其直接结合GPX4蛋白有关。DAQ与GPX4的相互作用,能显著缩短GPX4蛋白的半衰期,并且研究人员发现DAQ诱导的GPX4降解主要是泛素-蛋白酶体途径。蛋白质组学分析发现,E3泛素连接酶NEDD4介导了被DAQ修饰的GPX4的降解。被DAQ修饰的GPX4,其还原过氧化PE的酶活性明显降低,这可能是其被降解的主要原因。
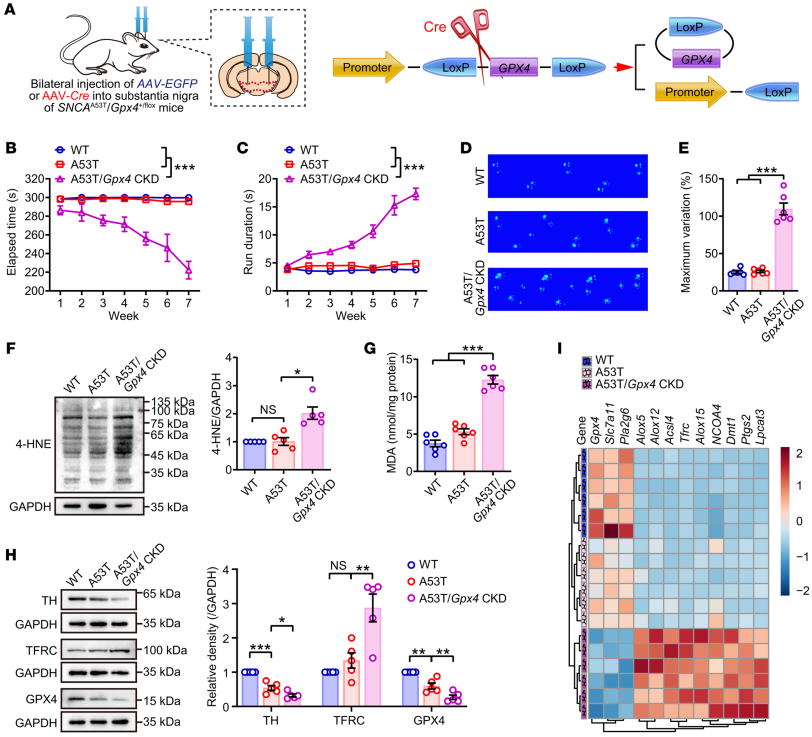
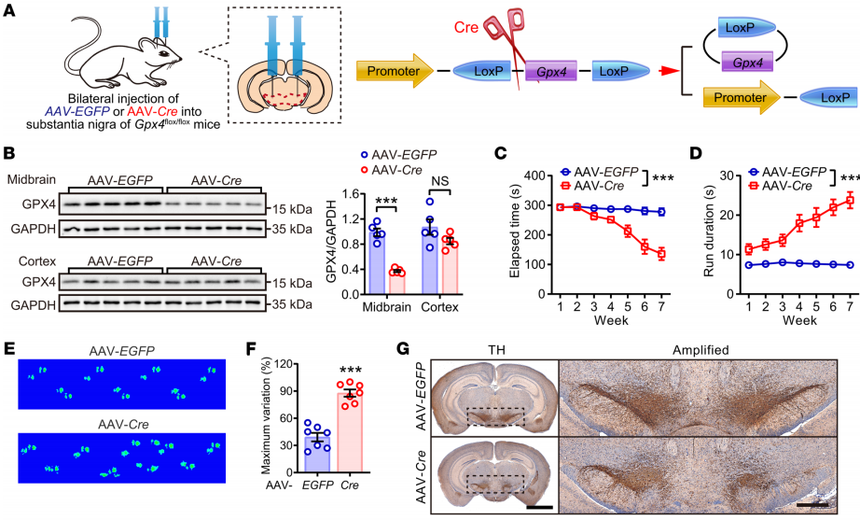
图3 DAQ和α-synuclein参与NEDD4介导的GPX4泛素蛋白酶体降解 为了探究GPX4在PD进展中的作用,作者利用SNCAA53T/Gpx4+/fl双转基因小鼠,给它们注射腺相关病毒介导的Cre重组酶构建体,条件性地敲除黑质中Gpx4的表达。运动行为试验显示,黑质中GPX4的缺乏加速了小鼠帕金森病的发展。这些动物的中脑还表现出脂质过氧化。囊泡单胺转运体2(VMAT2)的减少表明神经元受损和多巴胺(DA)代谢紊乱。这些多巴胺能神经元功能障碍的表型可能与突触核病相关帕金森病过程中GPX4不足引发的铁死亡反应激活有关。
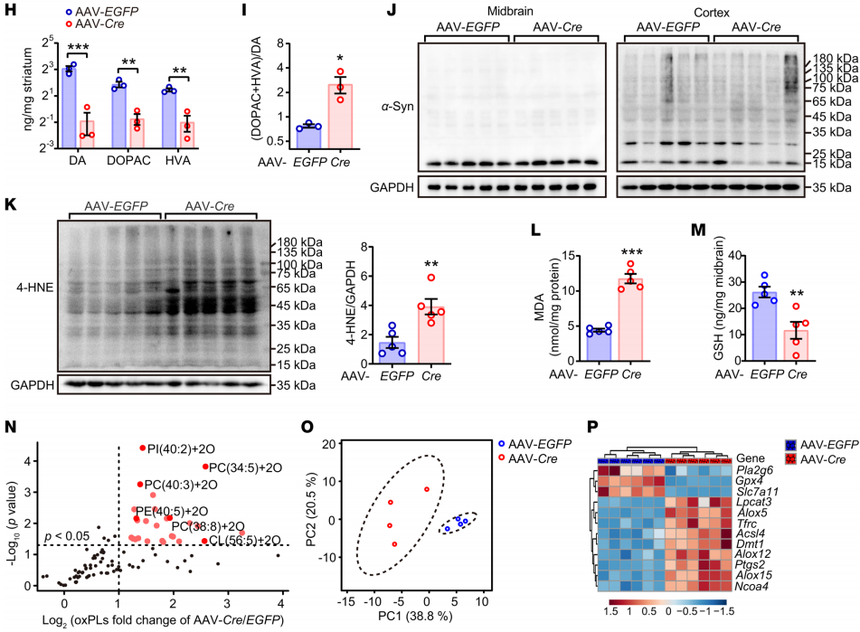
图4 GPX4对于维持对铁死亡相关脂质过氧化的抵抗是必不可少的 作者通过向Gpx4fl/fl小鼠注射AAV-Cre,进一步研究了过度激活脂质过氧化是否能单独诱发帕金森病。发现小鼠表现出运动协调功能受损、TH表达和DA代谢失调、多巴胺能神经元严重缺失、脂质过氧化终产物水平升高、GSH水平降低以及以磷脂种类间普遍氧化为特征的独特脂质特征。黑质中存在与铁死亡相关的基因,表明铁死亡信号通路被激活。
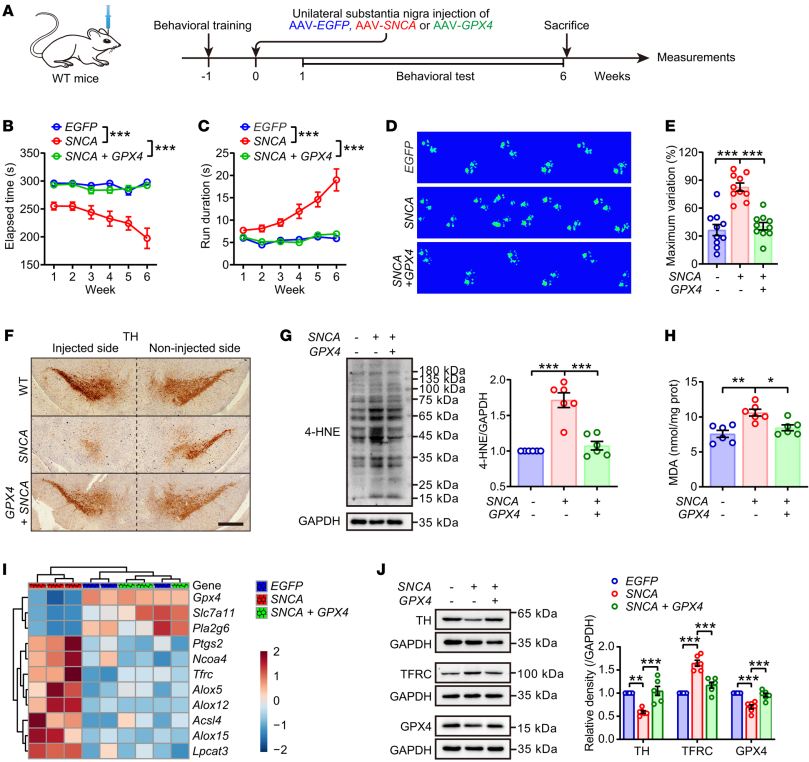
图5 GPX4对于维持对铁死亡相关脂质过氧化的抵抗是必不可少的 4. 补充GPX4可缓解突触核蛋白病和帕金森症 为了进一步证实GPX4在铁死亡和PD发病机制中的作用,通过单侧注射AAV-SNCA到黑质中过表达,测试小鼠PD模型中GPX4补充的效果,发现GPX4的补充不仅抑制了中脑中的α-突触核蛋白寡聚体的形成,而且显著改善了运动协调功能。GPX4有效地改善了SNCA相关的多巴胺能神经元退化和脂质过氧化物积累。此外,GPX4减弱了铁死亡的激活和TH表达的丧失,并破坏了多巴胺能神经元和DA代谢。 这些数据表明,GPX4是一个关键因子,通过其泛素化和随后在DAQ的指导下降解,保护多巴胺能神经元免受铁死亡和功能障碍的影响。
图6 补充GPX4可缓解突触核蛋白病和帕金森症 文章小结 综上所述,本研究提出,α-synuclein低聚物与多巴胺能神经元富含的DA的“狼狈为奸”(act in collusion),导致多巴胺能神经元发生铁和oxPLs依赖的铁死亡式进行性丢失,最终引发PD的发生和进展。该研究从多巴胺能神经元独有的生理特征出发,解释了PD疾病易感机制;并采用了靶点模型,深入阐释了铁离子和oxPLs依赖的铁死亡机制与多巴胺能神经元氧化损伤的内在联系。 |