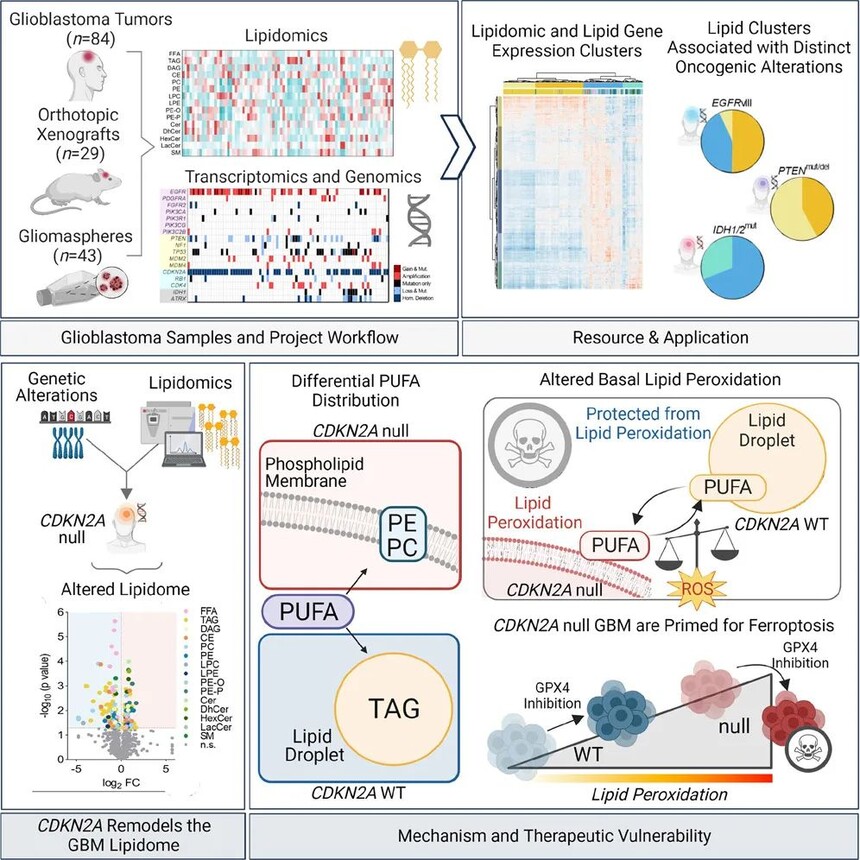
1.GBM及衍生临床前模型的分子和脂质组学
作者建立了一个大型分子注释的胶质母细胞瘤及其衍生物的体外和体内原位模型库,以寻找特定分子病变与脂质代谢表型之间的临床相关关系。分析了84个GBM患者、43个GBM人类细胞系和29个GBM小鼠模型的数据,包括脂质组学、转录组学和基因组组数据,以寻找癌细胞处理脂质的可能模式。结果显示,临床和临床前GBM模型库突出了GBM分子和脂质组学的异质性,GBM脂质组的异质性可能源于个体肿瘤之间致癌改变的多样性。
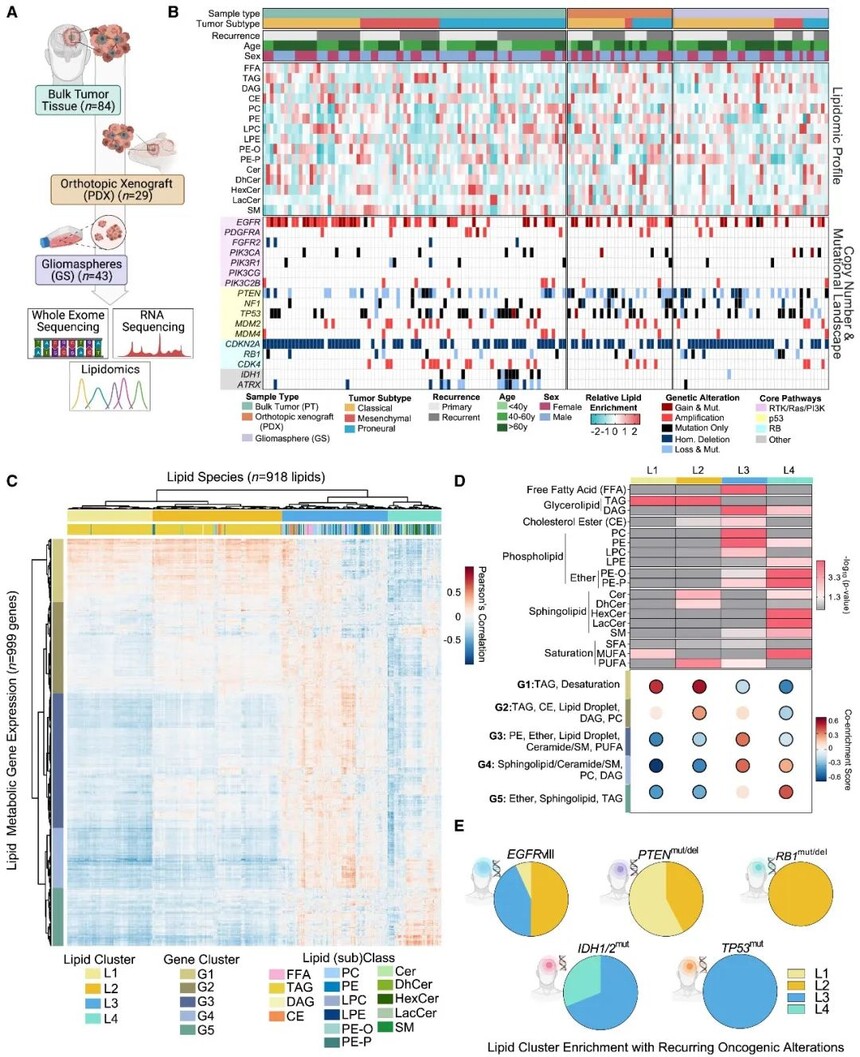
图1 GBM及衍生临床前模型的分子和脂质组学
2.CDKN2A缺失改变GBM脂质组
作者对患者来源的GS进行脂质组和蛋白质编码基因之间的相关性分析。分层聚类确定了两种不同的基因-脂质分组。对单个样本进行簇富集评分,测试它们与基因水平体细胞点突变和位点水平拷贝数改变的关联,发现唯一显著遗传改变定位于染色体9p21位点,即肿瘤抑制细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)。RNA表达证实CDKN2A是基因脂质组中在该位点表达差异最大的转录物。
主成分分析发现所有测量的脂质类别中CDKN2A野生型(WT)与CDKN2A缺失GSs分化。CDKN2A缺失与分布在15个可检测的脂质亚类以及四种脂质簇的195种单个脂质水平的显著变化相关。CDKN2A WT GSs中含量较高的脂质种类包括高度不饱和的酰基尾部和长度大于20个碳。shRNA介导的CDKN2A WT GSs中p14/p16表达的沉默使差异丰富的脂质种类的组成和酰基尾部特征转向了CDKN2A缺失的GSs。综上,CDKN2A状态对GBM中脂质亚群的尾长度和饱和状态有深远的影响。
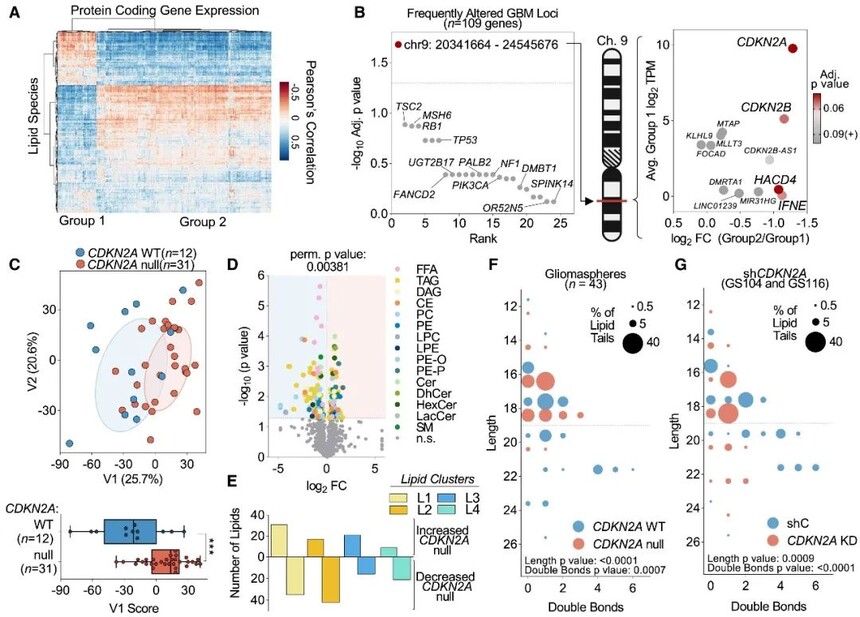
图2 CDKN2A缺失改变GBM脂质组
3.CDKN2A缺失使GBM细胞对脂质过氧化和铁死亡敏感
在CDKN2A缺失的GSs中,三酰甘油酯是大多数改变的单个脂质种类,CDKN2A缺失细胞中较短链饱和脂肪酸和单不饱和脂肪酸富集,并且CDKN2A缺失细胞的基础脂质过氧化程度更高。在CDKN2A WT GSs中沉默p14/p16表达会减少含有较长酰基链尾的PUFA TAG,脂质过氧化增加。因此,CDKN2A缺失改变了TAG的酰基尾部特征,导致GBM中脂质过氧化的基础水平较高。
作者假设CDKN2A缺失的GSs可能对诱导铁死亡敏感。在CDKN2A缺失GS中,用(1S,3R)-RSL3 (RSL3) 或ML210抑制谷胱甘肽过氧化物酶4(GPX4)导致明显的细胞凋亡。GPX4抑制仅在CDKN2A缺失GSs中增加脂质过氧化,而在CDKN2A WT细胞中没有增加。RSL3或ML210诱导的细胞凋亡可被铁死亡抑制剂处理。CDKN2A WT GSs中p14/p16的沉默增加了脂质过氧化和铁死亡易感性。
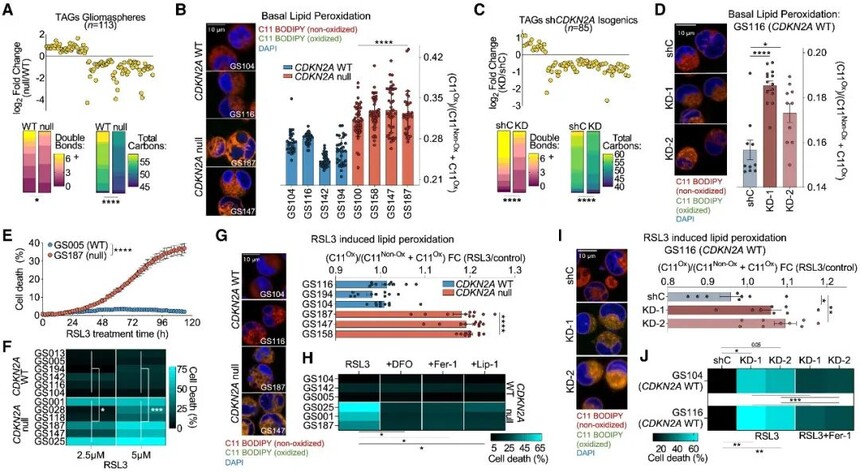
图3 CDKN2A缺失使GBM细胞对脂质过氧化和铁死亡敏感
4.CDKN2A缺失减少可氧化PUFA螯合到脂滴中
作者将PUFA花生四烯酸(AA)提供给CDKN2A WT和缺失GS并进行处理,发现显著提高了CDKN2A WT GSs中PUFAs对TAG物种的吸附;将AA添加到CDKN2A缺失细胞中可特异性扩增含有AA的PC磷脂库,AA处理显着增加了CDKN2A WT GSs中脂滴的形成,但在CDKN2A缺失中则不增加脂滴形成。
CDKN2A遗传状态会影响细胞内PUFA分布到不同的脂质类别中。CDKN2A介导的脂质组成变化是GBM对脂质过氧化和铁死亡易感性的基础。AA处理的CDKN2A WT 细胞需要DGAT1/2抑制剂才能将RSL3诱导的脂质过氧化和铁死亡提高到CDKN2A缺失GS中观察到的水平。
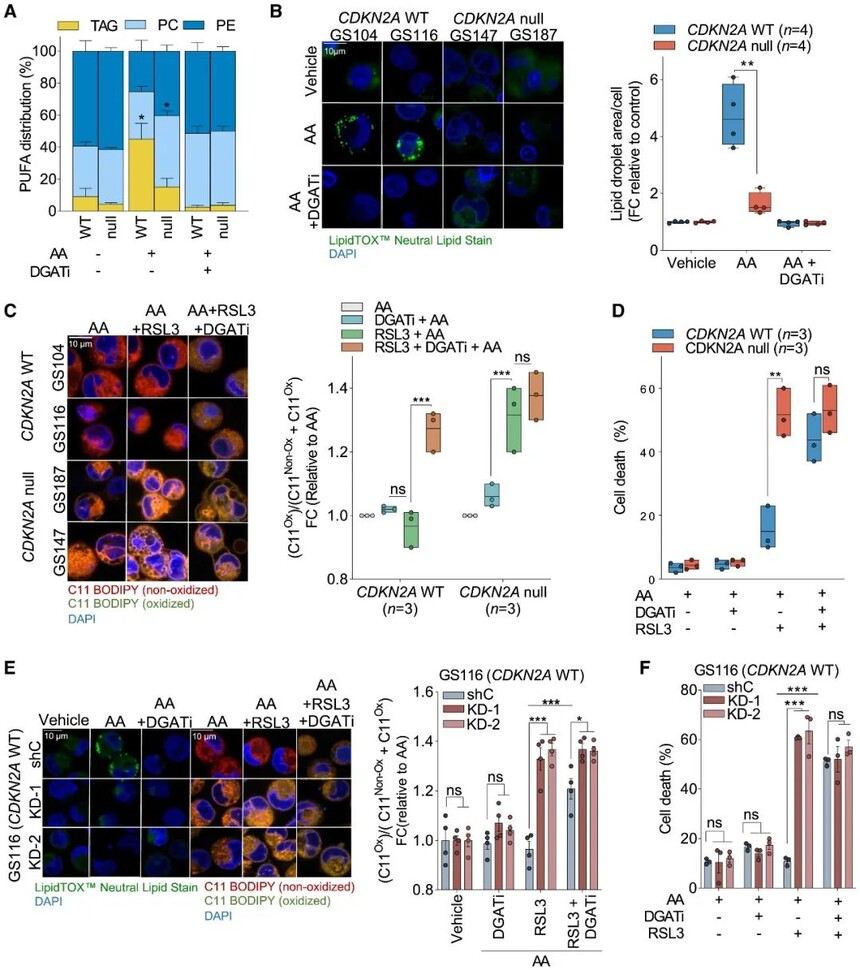
图4 CDKN2A缺失减少可氧化PUFA螯合到脂滴中
5.p16缺失导致GBM对铁死亡敏感
CDKN2A编码两种蛋白,p14和p16。作者假设p16可能调节GBM脂质代谢和对铁死亡的敏感性。首先敲除CDKN2A的外显子2消除了p14和p16蛋白水平,发现含有PUFA的TAGs的比例显著降低。接下来,将p16重新引入CDKN2A细胞中,发现PUFA TAGs增加,p16回接后PUFA TAG水平的恢复与将AA分流到脂滴的能力恢复相结合。通过测量脂质过氧化副产物丙二醛和相对于CDKN2A细胞的铁死亡敏感性,观察到p16表达的增加可以完全逆转基础脂质过氧化水平。因此,p16缺失足以重塑GBM脂质组的成分,使GBM GSs容易发生铁死亡。
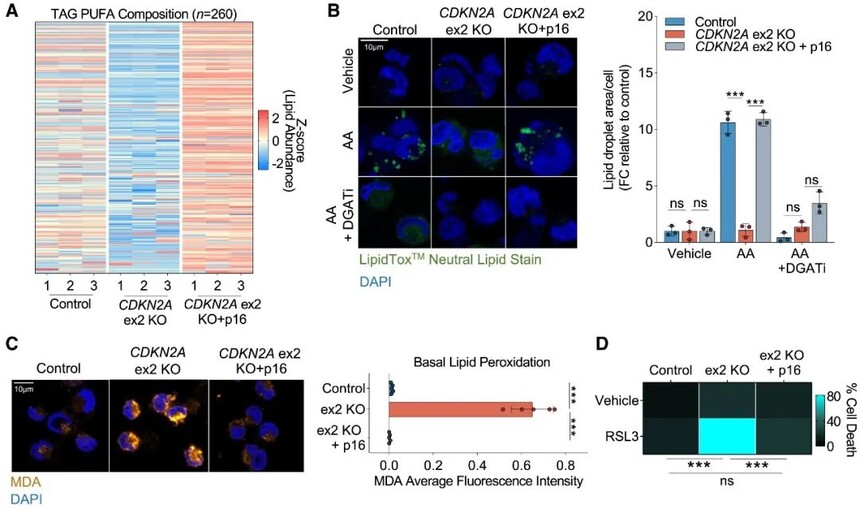
图5 p16缺失导致GBM对铁死亡敏感
6.GPX4抑制可降低体内CDKN2A缺失的GBM肿瘤负荷
作者探讨了CDKN2A的遗传状态是否影响GBM肿瘤体内脂质组和铁死亡潜能。发现CDKN2A WT原位PDX肿瘤与CDKN2A阴性肿瘤相比,富含更长的酰基尾部和更多双键的TAG,CDKN2A阴性PDX肿瘤显示出更高水平的脂质过氧化,提示CDKN2A缺失的肿瘤对铁死亡的诱导更为敏感。小鼠实验发现,所有三种GPX4 sgRNA都显著延长了两种不同的CDKN2A无效PDX模型的存活时间。GPX4的破坏对携带CDKN2A WT PDX肿瘤的小鼠没有生存益处。综上,GPX4抑制显著且选择性地改善了CDKN2A缺失的GBM肿瘤小鼠的预后。
作者确定了与CDKN2A遗传状态相关的特定PUFA TAG脂质表型在GBM患者的肿瘤中是否保守。发现与临床前GBM模型一样,GBM肿瘤中的CDKN2A缺失与含有高度去饱和长酰尾的TAG的比例减少有关。这些数据强调了细胞培养和异种移植研究结果的临床相关性,并进一步支持了CDKN2A缺失导致的脂质代谢重塑增加了脂过氧化,从而导致GBM导致铁死亡的结论。

图6 GPX4抑制可降低体内CDKN2A缺失的GBM肿瘤负荷