肿瘤转移是肿瘤恶性化发展的重要环节,也是肿瘤治疗失败的主要原因。目前有关肿瘤转移的成因说法繁多,相关的治疗手段也非常有限,因此寻找肿瘤转移的原因发现新靶点尤为迫切。
2023年4月13日,美国斯隆凯特琳癌症研究所 Karuna Ganesh教授为通讯作者,在顶尖期刊《Cell》(IF值为66.85分)上发表题为“Metastasis”的综述性文章,详尽总结了肿瘤转移研究的最新进展。下面笔者将这篇综述全文编译如下,供有兴趣的同学参考。

大多数与肿瘤相关的死亡,是由肿瘤转移引起的。转移的概念,随着相关研究的进展,不断发展、具有异质性、且涉及全身各系统。对于如何有效治疗肿瘤转移的新研究,仍在不断涌现。肿瘤转移具有一系列特征,这些特征可以促进肿瘤细胞在体内的播散、激活和休眠的动态平衡,以及促进瘤细胞定植于远处器官。上述过程的发生,是由转移瘤细胞的克隆选择、动态转变,以及选择免疫环境的能力所驱动的。在这篇综述文章里,作者回顾了转移的主要过程和最新研究进展,并着重强调了为转移性癌症开发更有效疗法的新兴策略。
转移,即癌细胞在远离其起源部位的器官中生长,是癌症的最终,且最致命的表现。绝大多数癌症患者死于转移性疾病,而不是原发性肿瘤。转移包括一系列过程,包括来自原发性肿瘤的细胞逐渐获得更强的侵袭力;通过血液、淋巴管或通过邻近结构的直接浸润种植;定植于远处器官,最终在远处器官中增殖。在上述过程中,肿瘤细胞具有不同表型,并在肿瘤微环境中,与其周围免疫细胞和基质细胞相互作用,以支持瘤细胞生长,并帮助瘤细胞逃避免疫系统的监视。原发性肿瘤通常可以通过手术和放疗等局部疗法治愈,转移性癌是一种影响多个器官的全身性疾病,它不仅可以通过直接定植器官并损害其功能,而且还可以通过改变分泌蛋白组构成及其代谢,最终导致患者死亡。对全身治疗的反应,在同一患者的原发性和转移性疾病中,可能具有截然不同的结果。由于转移性肿瘤对现有治疗方法耐受,临床上的转移性疾病,在很大程度上无法治愈。
下一代测序方法形式的技术进步,已经极大促进了基础癌症科学和临床肿瘤学的发展。通过上述技术,研究者已经积累了大量的表征疾病特异性表达模式,包括肿瘤微环境的肿瘤基因组数据,研究者通过对循环肿瘤 DNA(ctDNA)和循环肿瘤细胞(CTC)进行检测,来追踪疾病进展和对疗法的耐药模式,并阐明了原发性和转移性肿瘤的的异质性和克隆性。总之,这些研究成果,促成了新生物标志物和药物靶标的发展,并迅速推进了研究者对转移瘤细胞如何适应宿主环境,以确保其生存的机制研究。
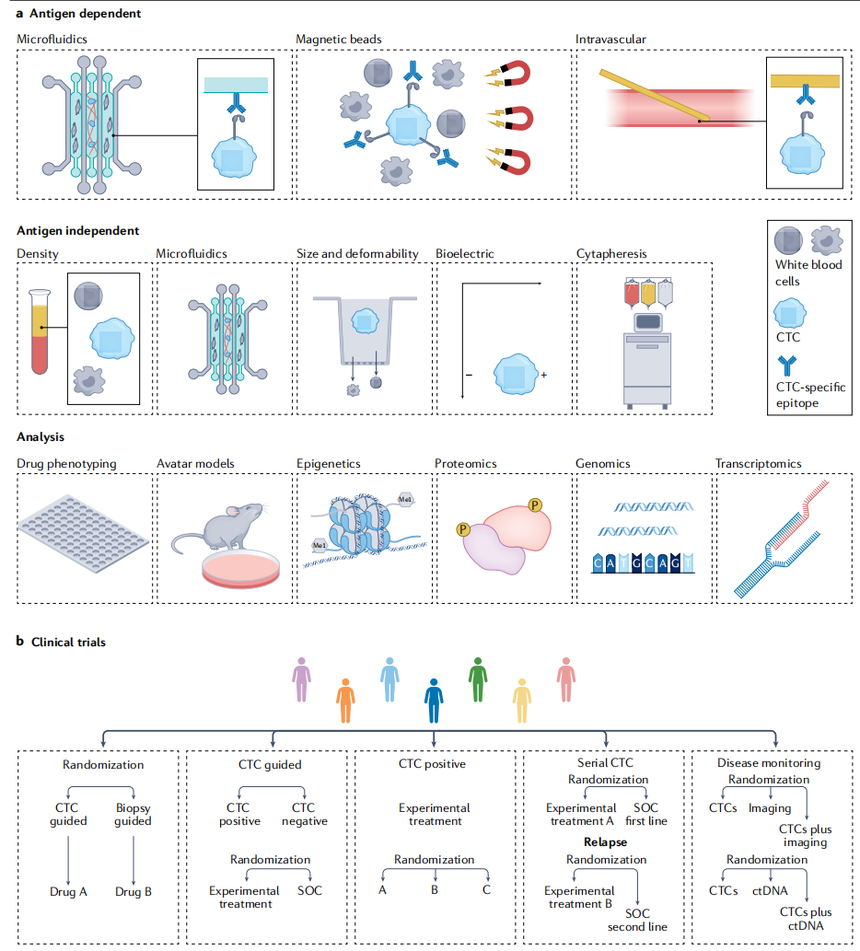
图为循环肿瘤细胞捕获、分析和临床试验设计。
(a)CTC捕获工具包括抗原依赖技术(例如,通过固定抗体、抗体包覆珠或涂层血管内导丝进行免疫捕获)和抗原非依赖技术(例如,密度梯度离心、基于变形性和尺寸的微流控系统、基于尺寸的过滤系统、基于电荷的技术或细胞分离)。(b)基于CTC的液体活检与组织活检随机化以指导治疗的选择;基于CTC存在(阳性与阴性)来指导治疗的选择(即实验性或靶向性与SOC);CTCs阳性的患者随机接受不同的靶向或实验性药物治疗;根据纵向或重复CTC评估进行随机化,以指导后续治疗路线(例如,靶向或实验性治疗与SOC);将单独使用ctc与SOC诊断方法(如医学成像)或使用其他液体活检分析物(如ctDNA)或每种单独模式与联合使用模式进行比较的随机试验。图片源自于https://doi.org/10.1038/s41568-022-00536-4
转移可分为三个阶段:播散、休眠和定植。在此期间,癌细胞经历一系列步骤侵入组织、在运输中存活,并定植于远处器官,这一过程统称为转移级联反应(图1)。在传播过程中,携带致癌驱动突变的肿瘤细胞,破坏基底膜侵入更深的组织层,从而在没有特异性生长因子的情况下生存。随后是瘤细胞内渗到近端血管或淋巴管中,并通过跨内皮迁移、毛细血管破裂、沿神经元迁移或直接局部扩散到邻近空间(如腹膜腔或胸膜腔),外渗到远处器官。在肿瘤细胞的循环中,CTCs 由于物理、氧化还原和免疫应激源而遭受广泛的损耗,这在小鼠模型中得到证实,从而导致原发肿瘤切除后血液中的 CTCs 数量大幅减少(图1)。CTC 作为单细胞,在富含干细胞样癌细胞的微团簇中循环,包被有血小板、中性粒细胞或肿瘤来源的基质细胞,这可以保护它们免受免疫监视,并赋予 CTC 的转移潜能。到达远处器官后,种植性肿瘤细胞(DTC)处于氧化应激状态,缺乏支持性生长因子或营养素,巨噬细胞、自然杀伤 (NK) 细胞和浸润性 T 细胞的免疫监视减弱。在上述状态下,幸存的 DTC 可以进入休眠期(图 1),在此期间,DTC要么细胞周期停滞,要么进入动态平衡。DTC的增殖爆发,可以被免疫消除,还可以被肿瘤微环境(TME)对增殖性克隆的遏制所抵消,在上述机制的作用下,DTC几乎没有净转移生长。种植和休眠在临床对应微转移性疾病,因为临床影像无法检测到 DTC,且患者不知道转移的发生。临床上明显的转移,来自成功发育的转移起始细胞(MIC),这些细胞已经适应TME,最终通过再生、血管生成和免疫抑制,来实现肿瘤生长和器官定植。转移级联,代表了微环境重编程,以及瘤细胞能够承受选择性微环境压力的癌细胞亚群。上述机制导致肿瘤不受限制地生长,从而导致器官功能障碍、全身机体功能崩溃,并最终导致患者死亡。这种连续的变化包括多个步骤,可以理解为转移的基础(图 2)。

图1.发生转移的各个阶段
转移包括三个阶段:传播、休眠和定植,这三个阶段可以共存,并在时间轴上重叠。MIC 起源于原发性肿瘤,并获得了侵袭性迁移的能力,然后作为 CTC,通过血液或淋巴管传播。大多数 CTC 因物理、生化和免疫应激源而被清除。CTCs 被困在远处器官的毛细血管床中,作为 DTCs 外渗,并迁移到器官实质中,以播种转移。DTC 在器官特异性血管周围播种。大多数MIC被特定生态位或系统免疫防御清除,很少有 MIC 存活下来,存活的MIC可逆生长停滞和免疫逃避,获得器官特异性生长适应,并选择其 TME 来逃避免疫监视。
经历转移级联的瘤细胞,具有很多特征。其中一些特征,源自于原发性肿瘤,是激活致癌基因和抑癌基因突变的结果,从而使转移瘤细胞具有不受控制的生存和增殖、自我更新、迁移和侵袭的特点。但即使具有这些特征,绝大多数离开原发肿瘤的瘤细胞,也无法存活并形成远处转移。因此,转移是肿瘤细胞进化过程的瓶颈。转移特异性的出现,要么从原发性癌细胞群中中选择特异的克隆细胞,要么具备非遗传动态适应性,使原发性肿瘤细胞适应不同转移阶段的需求(图 2)。

图2:转移的原理
MIC 获得功能性能力,使它们能够在恶劣环境中传播、定殖,并在多种应激条件下存活,这里总结为转移的原理。
1、肿瘤进化模式
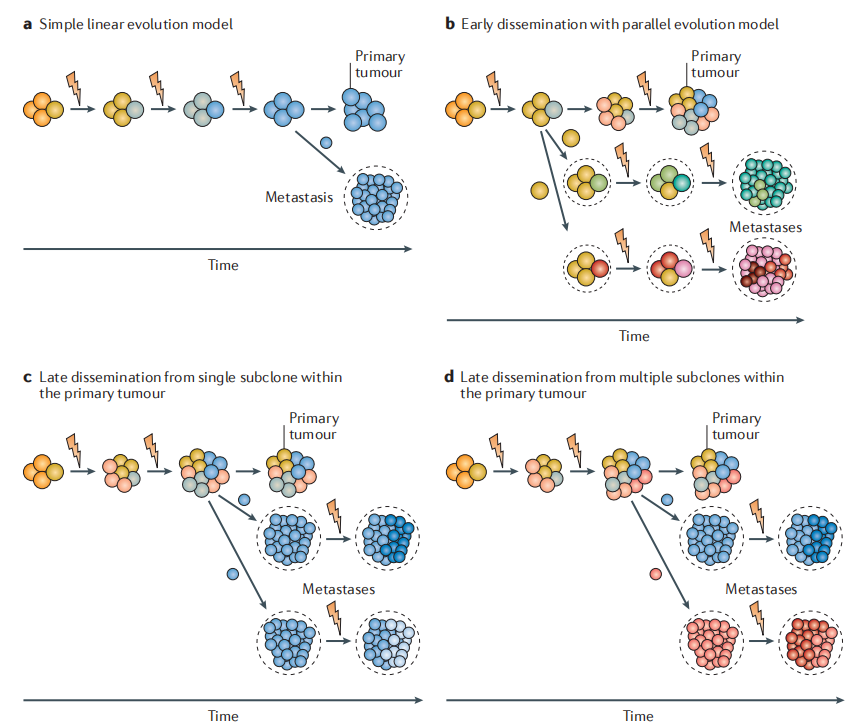
图为转移进化的模型和遗传异质性。
(a)由于生存和增殖优势,特异性克隆依次出现,在原发肿瘤中占主导地位(线性模式)。(b)早期扩散和平行进化模型,肿瘤细胞在原发肿瘤早期开始扩散,并在临床休眠期间,继续与原发肿瘤平行进化,直到它们获得转移能力,并增殖到肉眼可见的病变。(c)肿瘤随着时间的推移而进化,直到晚期出现的特异性亚克隆,成功产生多个转移灶。(d)来自原发肿瘤内多个具有转移能力的亚克隆晚期扩散。图片源自于doi:10.1038/nrc.2017.126
原发性肿瘤和转移灶之间的相关谱系及发育研究表明,转移过程中,有两种广泛认可的肿瘤进化模式:即线性模式和平行进化模式。在线性模式中,转移细胞从原发性肿瘤产生,较晚传播;而在平行进化模式中,癌细胞传播较早,转移细胞与原发性肿瘤细胞共享很少的突变,并与原发性肿瘤细胞分开进化。不同的播种模式(多克隆、单克隆和转移性再播种),进一步增加了转移性病灶的细胞异质性。基因组克隆进化的相关研究发现,在不同肿瘤类型和个体中,瘤细胞可出现早期和晚期转移。最近将 CRISPR-Cas9 编辑与单细胞 RNA 测序相结合的多重平行谱系相关研究,创建了可进化的追踪系统,表明在转移瘤中,线性和平行进化模式可以共存。
2、TME的空间影响
随着空间基因组学的进展,研究者对肿瘤内异质性、亚克隆变异和局部 TME 的作用,有了更深入的了解。TME 包含多种免疫细胞和基质细胞,它们与癌细胞相互作用,并共同进化,TME可以同时具有促肿瘤和抗肿瘤作用。对乳腺癌患者 TME 的空间分析发现,不同的癌症亚克隆形态,与不同程度的局部免疫浸润有关。小鼠肺腺癌的体内空间 CRISPR筛选实验发现,肿瘤细胞中的特定基因敲除,会导致免疫环境和 T 细胞浸润的改变。上述研究表明,肿瘤细胞经历了应激选择的局部变化,亚克隆遗传在转移瘤中,可能促进局部微环境生态位的建立。人类白细胞抗原 I 类等位基因杂合性缺失,在多种癌症类型转移的肿瘤亚克隆群落中富集,而强免疫原性新抗原,在复发性胰腺癌中优先丢失。种系遗传,也会影响转移倾向。最近的研究表明,APOE 基因的种系突变,会改变免疫细胞的抗肿瘤反应,并在黑色素瘤小鼠模型中,导致不同TME 成分的产生。目前,研究者在临床样本和临床前实验模型中,越来越多地应用空间和谱系追踪技术,这有望进一步揭示 TME 对 MIC 选择的影响,以及 MIC 选择 TME 成分的具体过程,以对MIC生存的机制深入理解。
3、拷贝数改变
尽管突变对肿瘤的发生至关重要,但大规模基因组研究表明,成对的转移性和原发性肿瘤,表现出相似的体细胞突变,它们极少具有转移特异性体细胞突变。研究者在肿瘤进展后期发现新的体细胞突变,这些突变的功能意义,通常与治疗耐药性有关。然而,与原发性肿瘤相比,在某些肿瘤的转移病灶中,可见拷贝数扩增增加和染色体异常,但并非在所有癌症的转移灶中都是如此。MYC扩增,通过募集更多肿瘤相关巨噬细胞(TAM),促进转移,从而导致更大规模的血管侵袭,这为非整倍体在驱动转移中的功能性作用,提供了可靠证据。然而,在大多数癌症中,非整倍体在肿瘤进展中发挥的作用,至今仍然存在争论。总的来说,基因变化可能促进转移,但在大多数情况下,相关研究结果不足以解释为什么一些癌细胞转移,而另一些不转移。
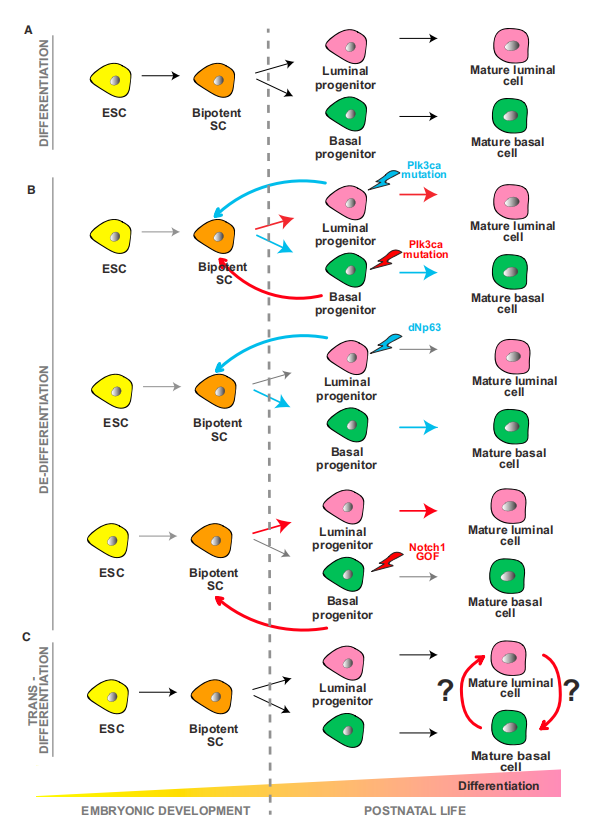
图为上皮细胞分化和可塑性的类型,以及它如何与胚胎发育过程中更原始的多能性状态之间的关系。
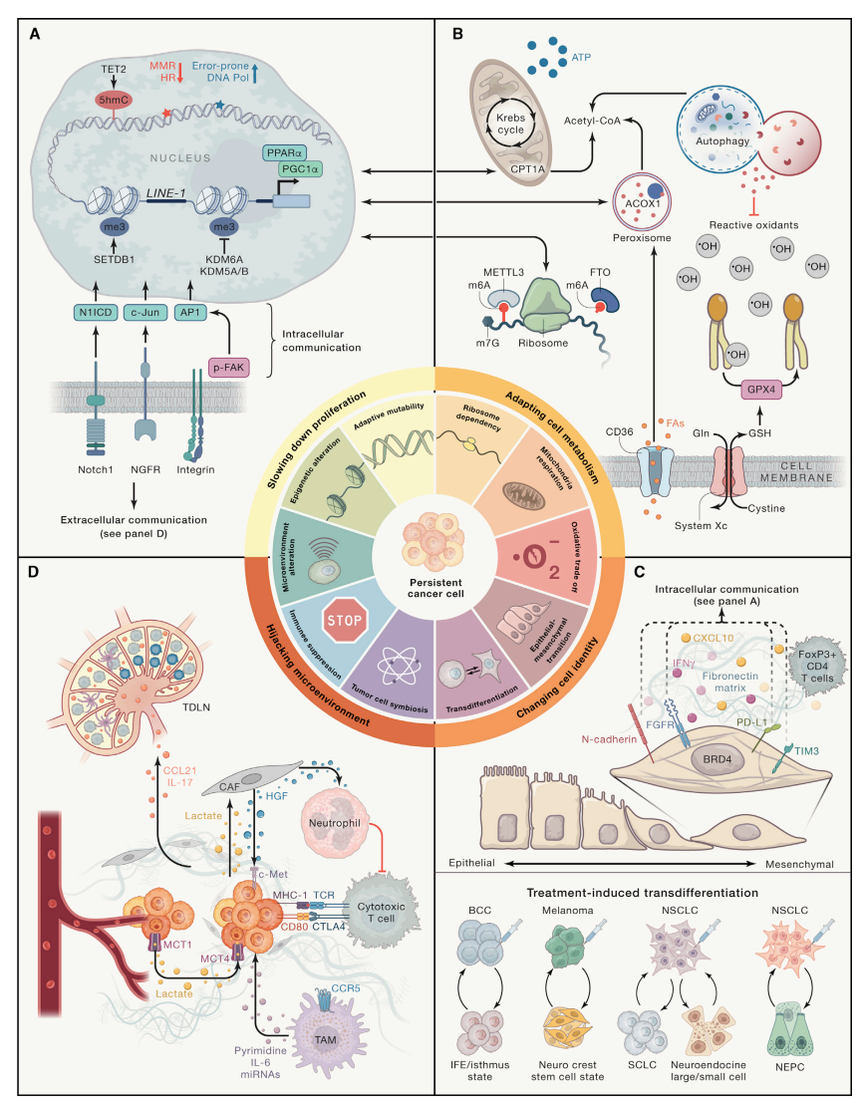
临床样本的单细胞分析结果,以及复杂的动物和患者来源的肿瘤模型研究,揭示了晚期癌症中的肿瘤内和肿瘤间转录异质性,这些异质性,不能用获得性基因组改变来解释。因此,表型可塑性,即对转移级联的动态非遗传适应,并对 TME 变化做出反应的能力,正在成为转移的首要标志及研究热点。可塑性允许 MIC 进入动态休眠、转分化并动态调整MIC状态,以适应代谢、氧化还原和免疫应激源(图 3A)。最近对转移性小鼠模型的研究表明,癌细胞在从原发性肿瘤,发展为 MIC 和器官特异性转移的过程中,经历了多种表型转变。小鼠肺腺癌模型中的体内谱系追踪和单细胞转录组学分析显示,具有高可塑性的原发性肿瘤亚克隆群落,在匹配的转移灶中高度富集,表明原发部位的可塑性,是转移的先决条件。目前相关研究一个重要的新兴主题,是相同的分子和通路,在肿瘤进展过程中的不同背景下,可能具有不同的作用,特别是在原发性肿瘤增殖与肿瘤传播和休眠期间。因此,将癌症相关基因指定为致癌基因或肿瘤抑制基因,在动态转移可塑性的研究背景下,经常出现矛盾结果。
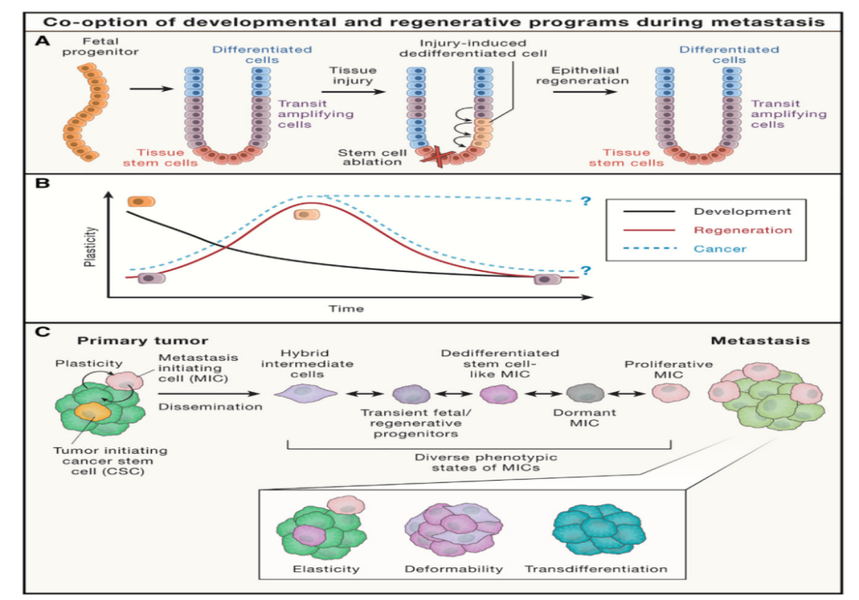
图3. 转移癌细胞相关的胚胎发育和伤口愈合的再生程序。
(A)在体内平衡期间,组织特异性干细胞不断产生,并转运祖细胞和成熟分化细胞。组织损伤后,分化的上皮细胞去分化,以重新进入组织胎儿样、损伤相关的祖细胞状态,去分化的上皮细胞可以分化为组织干细胞,然后分化为不同的细胞,恢复上皮完整性。
(B)细胞可塑性,在胚胎发育过程中,逐渐受到限制。在组织损伤后,分化受限的细胞,经历了可塑性的短暂增加。发育和再生祖细胞,在适应肿瘤进展期间的应激同时,激活了癌细胞相关的增选程序,转移中的癌细胞是否保持高度可塑性,目前仍不清楚。
(C)分散的 MIC 具有高可塑性状态。这些状态包括混合 EMT 状态、损伤相关的瞬态祖细胞样状态或免疫逃避休眠状态。在转移性定植期间,MIC 可以出现再生表型异质性,这些MIC可以进入休眠或启动肿瘤生长,重新进入类似于原发性肿瘤的状态,转移瘤细胞仍然处于MIC 样状态(可变形性),或经历谱系可塑性,进入新的细胞状态(转分化)。
1、基因表达的应激反应调控
大量相关研究结果,发现了特定于转移级联的离散步骤的基因表达程序。表观遗传机制,包括 DNA 甲基化、组蛋白修饰、3D 染色质组织和非编码 RNA,在不改变基础 DNA 序列的情况下,可以影响基因表达,为转移瘤细胞对微环境输入的动态响应,提供了多种可能性。关键转录因子(包括 SOX10 和 RUNX)的激活,可以通过表观遗传,介导转移瘤细胞的可塑性形成。组蛋白修饰的动态变化,可以改变染色质的可及性和结构。含有棕榈酸的高脂肪饮食,可以通过组蛋白 H3 赖氨酸 4 三甲基化的沉积,促进口腔鳞状细胞癌和黑色素瘤的远处转移。MIC 采用多种应激反应机制,通过转录后基因调控、自噬、和未折叠蛋白反应,促进瘤细胞的远处转移,这也是实体瘤中代谢和免疫逃避可塑性的决定因素。RNA 结合蛋白在转移过程中,协调细胞重编程和 TME 相互作用,调节 RNA 修饰、mRNA 剪接、定位、翻译、稳定性和降解。RNA N6-甲基腺苷(m 6 A)读取器 YTHDF3 的过表达,可以通过增加富含 m 6 A 的转录物的翻译,促进癌细胞与脑内皮细胞和星形胶质细胞的相互作用,以及瘤细胞的脑转移。具有低水平线粒体 RNA 胞嘧啶 5 甲基化 (m5C) 的癌细胞,减少了线粒体编码的氧化磷酸化复合物的翻译,抑制糖酵解到氧化磷酸化的转变,从而阻断了口腔鳞状细胞癌的转移。tRNA 的动态表达,通过调节具有差异密码子使用的基因,进一步促进MIC的可塑性。总之,这些研究表明,癌细胞可以通过调节表观遗传、转录和转录后改变,来动态切换其表型状态,以响应来自不断进化的器官特异性微环境的信号。
2、代谢适应
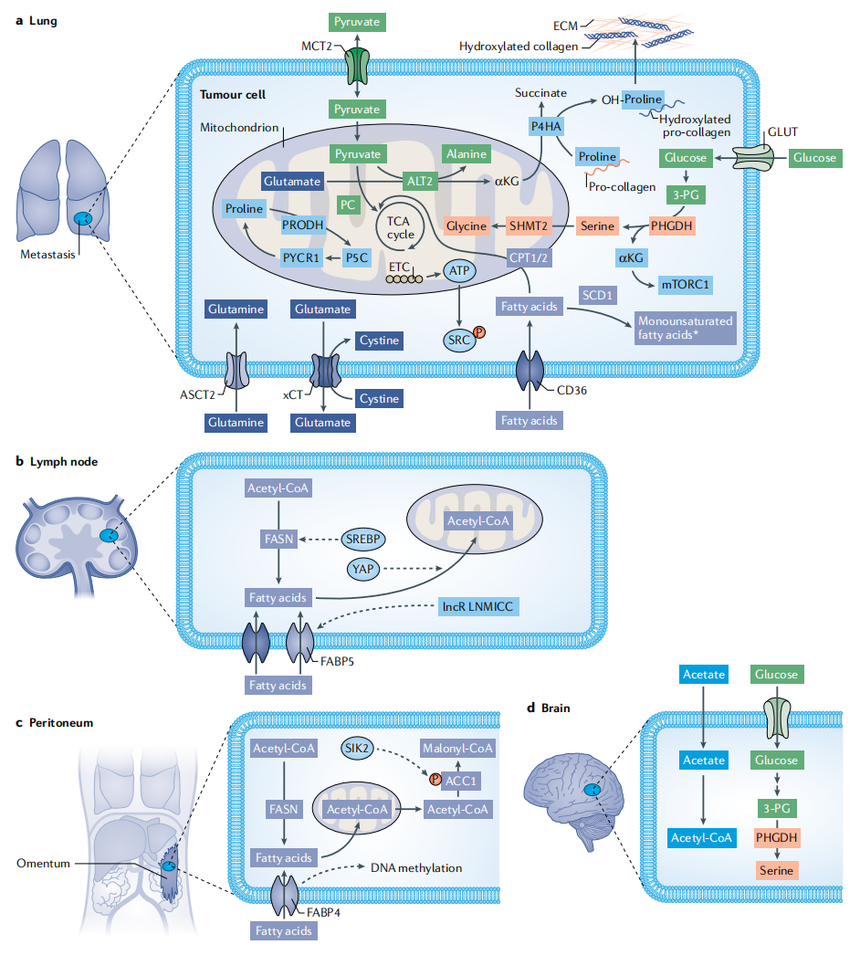
图为癌细胞在远端器官定植的代谢。
不同的营养物质和代谢途径支持转移性癌细胞在肺(a)、淋巴结(b)、腹膜(c)和大脑(d)的定植。图片源自于https://doi.org/10.1038/s41568-020-00320-2
尽管肿瘤向有氧糖酵解的代谢转变(Warburg 效应),是公认的癌症标志,但研究者越来越认识到,代谢途径的通量,可以在癌症进展过程中动态改变。DTC 可以使它们的新陈代谢适应环境压力,包括氧化压力或营养可用性,导致瘤细胞在循环中和在远距离器官种植后存活。来自不同肿瘤的转移性癌细胞,可以增加脂质的摄取、合成和利用。微转移肿瘤可以利用自噬和巨胞饮作用,来应对外来器官环境中的营养或生长因子缺乏。总的来说,癌细胞在循环和接种过程中,将营养物质的代谢从合成代谢状态改变为分解代谢状态,然后再回到合成代谢状态,以支持转移生长。活性氧(ROS)可通过铁死亡,诱导细胞死亡。然而,癌细胞可以减少多不饱和醚磷脂的合成,在体内转变为抗铁死亡状态,或者通过增加油酸合成,进而增加转移。在小鼠胰腺导管腺癌中,最初专家认为,ROS促进癌症的发生,但后来的研究发现,ROS可以促进瘤细胞的转移。因此,ROS 的可逆作用,使肿瘤从增殖表型到侵入表型的相互转换,成为可能。磷酸甘油酸脱氢酶(PHGDH)是葡萄糖衍生丝氨酸合成中的限速酶,可促进癌症增殖,而 PHDGH 依赖性唾液酸合成和整合素糖基化的缺失,会增加瘤细胞的转移性。这些研究强调了代谢可塑性在癌症进展中的重要性,相同的分子和途径,在增殖和转移扩散过程中的不同步骤中,发挥着不同的作用。
虽然之前的研究,已经确定了与转移相关的不同个体基因和通路,但用于转移状态的转录组、表观基因组和蛋白质组分析,正在揭示转移瘤细胞特异的表型。目前新兴的专家共识是,许多癌症通过激活功能相关基因的共调节模块,来同时获得转移所需的表型。此类基因网络,通常是产生癌症的组织发育或再生所需的基因网络,癌症特有的新基因程序,也可能对肿瘤转移,做出重要贡献(图 3 )。
1、发育、再生和转移
在胚胎发育过程中,全能受精卵的后代,随着器官的成熟,逐渐在可塑性方面受到限制。大多数成体组织内,含有组织驻留干细胞亚群,这些干细胞的后代,可以分化为该组织的各种细胞类型,但不能分化为其他组织。在这种稳态组织干细胞中,获得致癌驱动突变可导致癌症,称为“癌症干细胞”。然而,最近的研究表明,组织干细胞不必是受谱系限制的细胞群,而具有亚稳态表型,许多细胞具有可塑性,尤其是在损伤后的组织再生过程中(图3)。在肺中,炎症损伤诱导基底细胞,进入混合损伤相关瞬时祖细胞(DATP)状态,混合表达来自多个正常肺上皮细胞谱系的基因。DATP 经历可塑性,进入组织驻留的干细胞样肺泡 II 型细胞,随后分化成多种肺细胞类型,以在受伤后恢复上皮功能和结构。在小鼠肺腺癌中,具有多向分化潜能的高可塑性细胞状态,被确定为转移的前兆,在小鼠和人类肺腺癌转移中,研究者发现了更多发育原始转录基因程序的重新获得。类似地,结直肠原发性肿瘤,是由 Lgr5 +癌症干细胞引发的,但转移的瘤细胞, Lgr5 表达丢失,而是获得新标记的表达,包括 L1CAM和 EMP1。L1CAM 不由健康的肠上皮细胞表达,但由损伤后的再生祖细胞表达,并且是伤口愈合、转移起始和治疗后肿瘤再生所必需的。已建立的小鼠结直肠转移瘤模型,在转移生长过程中,从 Lgr5低转移起始状态恢复到 Lgr5 +状态,尽管目前尚不清楚这种动态改变在晚期人类癌症中的保留程度。
上皮-间质转化 (EMT),是在转移中的发育可塑性最佳研究示例。EMT包含细胞组织的多种动态变化,包括细胞极性的丧失和上皮细胞粘附分子的下调,从而导致迁移和侵入邻近组织的能力增强。这是由上皮基因的 SNAIL 和 ZEB 转录抑制因子的协调和动态调节功能驱动的。EMT 首先发生在胚胎原肠胚形成过程中,并且随着 DTC 获得迁移表型,从而促进原发性肿瘤的侵袭转移。EMT 是否是转移的先决条件,目前一直存在争议,因为这很难在临床样本中证明。一些研究表明 ,EMT 不是转移所必需的,但会导致肿瘤的耐药。最近的研究表明,在癌细胞中,常常发生与侵袭、转移和化学抗性相关的EMT。最近的研究发现,在同一细胞中,共表达上皮和间充质标记物的混合 EMT 状态,可驱动多种癌症转移,这一发现挑战了将 EMT 视为二元开关的传统观点。随着 MIC 在远处部位获得转移相关的特异性生长能力,由MIC再生的肿瘤有以下特点(1)弹性变化,转移肿瘤可以复制它们原发肿瘤的表型特点,最常通过间充质-上皮细胞转化(MET)发生;(2) 可变形性,即原发肿瘤可以保持类似 MIC 的状态;或(3)转分化性,MIC在经历谱系可塑性后,从而进入不同于同源原发性肿瘤的新细胞状态(图 3 C)。这三种特点的具体贡献,可能因个体、肿瘤基因型和起源组织而异,并且仍有待在临床转移中研究。
1、不断发展的肿瘤微环境
DTC 必须逃避组织驻留和系统免疫的攻击,才能成功地在远处器官中定植。转移免疫的重要性,来自器官移植的相关研究,在这些研究中,免疫抑制的肾移植受者,因早期黑色素瘤细胞存在于供体肾脏中,而发生广泛转移。在原发性肿瘤中,肿瘤浸润淋巴细胞的增加,是结直肠癌患者无复发生存的有利预后生物学指标,而 T 细胞和 NK 细胞的耗竭,会增加实验模型中的转移。增强抗肿瘤免疫力的免疫检查点抑制剂(ICI),彻底改变了转移性癌症的临床治疗方案。在肿瘤细胞中,阻断 PD-1、CTLA-4 和 LAG3 的T 细胞受体-配体相互作用,可以在临床上诱导有效的治疗反应,这现在是许多实体瘤的标准治疗方案。尽管ICI取得了这些成功,但由于缺乏肿瘤抗原、抗原呈递缺陷、T 细胞活化缺陷和 T 细胞排斥,一些肿瘤类型对 ICI 没有反应,并且缺乏肿瘤 T 细胞浸润,这些肿瘤被称为“冷肿瘤”。“冷肿瘤”的产生,与免疫抑制 TME相关。即使对于最初对 ICIs 有反应的肿瘤,由于慢性 T 细胞刺激,导致功能减退,T 细胞耗竭也可能导致耐药性的产生。至关重要的是,ICI 似乎对原发性肿瘤和微转移,比对已发生的显著转移更有效。在一项关于三阴乳腺癌的研究中,虽然在化疗中加入pembrolizumab ,在肿瘤细胞上 PD-L1 配体低表达的转移性三阴性乳腺癌,总体生存获益不明显,无论 PD-L1 表达状态如何。在早期乳腺癌中,添加 pembrolizumab ,可显著延长无病生存期。在黑色素瘤和肺癌的相关研究中,也有类似结果表明,ICIs 在辅助/新辅助治疗中,比在晚期转移中更有效。因此,了解转移中进行性免疫抑制的机制基础,将免疫学“冷”肿瘤变“热”,以及提高免疫疗法在转移性癌症中的疗效,至关重要。
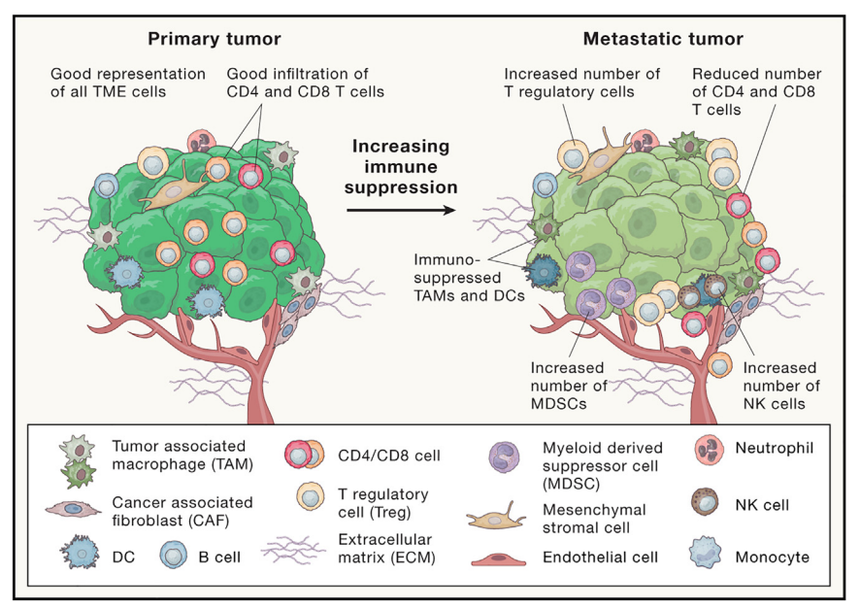
图4. 转移性肿瘤微环境
TME 的组成和共同选择,对于肿瘤的生长和进展至关重要。TME 的主要成分是先天性和适应性免疫系统,以及基质细胞的成分:组织驻留和骨髓来源的巨噬细胞,极化为免疫抑制性 TAM、单核细胞、骨髓来源的抑制细胞、T 细胞、NK 细胞、树突状细胞、血管和淋巴管、癌症相关的成纤维细胞和 ECM 的成分。TME 中免疫细胞的环境和免疫调节受体的表达,在转移性肿瘤中变得更加抑制。
外渗到远处器官的 DTC ,首先遇到组织驻留的巨噬细胞和 NK 细胞,而后者进一步募集局部和循环免疫细胞,以对抗新播种的转移。作为回应,癌细胞发展出适应性机制,可以促其逃避或抑制免疫反应,限制抗原识别,增加阻断适应性免疫系统的受体表达,并分泌免疫调节细胞因子、细胞外囊泡和生长因子。TME包括T细胞和B细胞;NK细胞;骨髓细胞,包括 TAM、骨髓来源的抑制细胞、树突状细胞和嗜中性粒细胞;基质细胞,包括癌症相关的成纤维细胞、周细胞和内皮细胞;和细胞外基质(ECM)成分,它们都协调此类适应(图 4)。TME可以同时具有促瘤和抑瘤作用,但随着时间的推移,其作用越来越趋向于促瘤(图4)。反过来,在临床试验中,越来越多地探索 针对TME的靶向治疗,无论是作为单一药物还是与 ICI 联合使用。转移前,TME可发生局部和全身免疫抑制。原发性肿瘤脱落,进入循环系统的细胞外囊泡,可释放细胞因子,以诱导骨髓来源的免疫细胞募集和免疫抑制重编程至转移前器官,在转移器官,它们与驻留细胞一起形成“转移前生态位”,有利于瘤细胞的转移性定植。协调组织驻留细胞、募集的骨髓细胞和浸润性肿瘤细胞功能的信号通路,可以进一步加强转移定植过程中出现的免疫抑制环境。
2、淋巴结转移
转移性免疫抑制也可以由运输中的癌细胞介导。肿瘤的淋巴结受累,可作为未来转移性疾病的有力预后生物标志物,并在临床分期标准中反映。然而,克隆系统发育的分子重建研究表明,淋巴结和远处转移,主要来自原发肿瘤中的独立亚克隆。最近的研究表明,淋巴结不是转移过程中的被动分期站,而是诱导全身免疫抑制的关键部位。在淋巴结转移的模型中,DTC 暴露于淋巴结中的 IFN-γ ,会诱导干扰素刺激的基因程序,上调 PD-L1 和 MHCI 表达,从而促进 NK 逃避和 T 细胞抑制。至关重要的是,淋巴结定植,可以通过诱导肿瘤特异性 T 调节细胞、增加巨噬细胞上的 PD-L1 表达,以及将树突细胞从迁移亚型转变为驻留亚型,从而改变全身免疫反应。相关研究证实,注射了淋巴结肿瘤供体白细胞的肿瘤移植小鼠,更容易发生肺转移,这表明淋巴结转移,可以通过诱导肿瘤特异性免疫耐受,来促进远处器官的转移。对淋巴结依赖性免疫的进一步研究,可能会发现新的生物标志物和治疗靶标,以扰乱转移性癌症中的免疫抑制回路。
图为癌细胞休眠的相关机制。
(A)减缓增殖;(B)适应细胞代谢;(C)更改表面标记;(D)与肿瘤微环境相互作用。图片源自于https://doi.org/10.1016/j.cell.2020.10.027
在休眠期间,DTC 不会形成肉眼可见的病变,并且患者在数月或数年后复发之前,不会有临床表现。早期癌症的小鼠模型表明,每个器官中均存在DTC;然而,DTC最终只以特定癌症的方式,在特定组织中生长。在一些癌症中,如雌激素受体阳性乳腺癌,在术后20年才会出现远处复发,而其他癌症,例如小细胞肺癌,在诊断时就表现出侵袭性扩散,休眠期很短。这些观察结果表明,不同肿瘤类型的休眠进入和再觉醒,具有异质性。
临床休眠,反映了细胞休眠的动态平衡。其中 ,DTC 通过可逆地控制生长停滞和休眠的调节程序,使肿瘤细胞进入静止状态,瘤细胞增殖和定植的反复随机尝试,被免疫、物理和代谢障碍所中止。细胞可塑性,是维持休眠的一个关键特征。在乳腺癌模型中,早期 DTC 激活了与多能性样可塑性相关的间充质样程序,后者协调瘤细胞传播,并实现瘤细胞的长时间休眠,这一过程由转录因子 ZFP281 控制。休眠 DTC 通过表观遗传,调控维持其状态,例如组蛋白修饰和增强的 DNA 甲基化,导致抑制性更强的染色质状态、转录/转录后基因调控以及细胞应激反应和自噬的激活。癌细胞增殖,进一步受到 DTC 或 TME 成分释放的生长抑制信号的控制,这些成分包括 TGFβ、BMP 和 Wnt 拮抗剂,以及改变的 ECM 成分,如胶原蛋白和层粘连蛋白亚型。由于肿瘤缺氧或营养限制,对 TME 的代谢适应,进一步促进了缓慢循环的细胞状态。通过激活未折叠的蛋白质反应,进入细胞静止状态,这在功能上与免疫逃避相结合。NK配体的下调,或 MacroH2A 组蛋白变体的上调,这些变体与细胞周期停滞和衰老相关的炎性细胞因子分泌有关。这种细胞静止状态,与免疫抑制的耦合,本质上是一些成体组织干细胞的固有特性,可能在组织再生过程中具有重要功能。但这种细胞静止状态,也有助于协调异质性肿瘤中静止细胞周围的局部免疫逃避生态位。
为了启动宏观转移生长,休眠的癌细胞必须重新进入细胞周期,或逃避免疫监视。对局部宿主环境的直接炎症应激源,例如手术、烟草烟雾或接触细菌脂多糖,可以触发休眠 DTC 的重新激活和生长。在小鼠转移模型中,癌细胞可以诱导中性粒细胞产生支持转移的中性粒细胞胞外因子,从而刺激乳腺癌的侵袭、迁移和肺转移。从休眠中苏醒,是衰老宿主的固有特征。在小鼠模型中,衰老骨髓中的休眠 DTC频率降低,癌细胞增殖活性增强,这与促增殖性炎性细胞因子增加,以及休眠促进因子下调有关。ECM 的年龄相关重塑,会刺激黑色素瘤转移。衰老的成骨细胞,可以促进黑色素瘤的骨转移。老年肺成纤维细胞,可以通过增加可溶性 WNT 拮抗剂 sFRP1 的分泌,来重新激活休眠的黑色素瘤细胞。
DTC 几乎可以扩散到所有器官;然而,不同的癌症类型,钟爱某些器官,这种现象称为转移性器官趋向性。器官特异性转移的决定因素,已在大量经典研究中得以证实。在这里,作者着重于介绍新兴的相关研究。转移的趋向性,由癌细胞到达器官的特点和有利于 DTC 播种、定植的器官特异性微环境所决定。结直肠癌的主要转移部位是肝脏,这是因为从肠道血行播散的癌细胞,可以通过肠系膜毛细血管进入肝门静脉,肝窦可以作为它们的毛细血管床。然而,肝脏也是 90% 的葡萄膜黑色素瘤患者的转移部位,考虑到眼睛中的原发肿瘤位置,这在解剖学上不易解释。因此,DTCs 可以理解为“种子”,特定器官生态位可以理解为肥沃“土壤”,在上述情况下,易于转移瘤的生长。DTC 之间存在的转录和代谢异质性,使得DTC能够选择在特定器官中生长、克隆,而DTC的可塑性机制,使得DTC能够动态适应新的组织生态位。一项研究显示,心内注射三阴性乳腺癌细胞系 MDA-MB-231,会导致具有不同基因表达特征的亚克隆的转移扩散,转移的肿瘤细胞优先定植到大脑、骨骼和肺部。细胞外代谢物,可以进一步塑造转移生长的生态位和内在细胞代谢微环境,例如,当葡萄糖来源变得有限时,脑转移瘤细胞可以代谢消耗乙酸盐、谷氨酰胺和支链氨基酸。结直肠肝转移,可以增强肌酸激酶脑型酶的分泌,将肝细胞释放的细胞外肌酸转化为磷酸肌酸,然后被溶质转运蛋白 SLC6A8 摄取到转移性癌细胞中,以促进 ATP 的产生。
具有新型旁分泌信号的癌细胞的生态位适应性,可以诱导靶器官周围细胞的可塑变化,促进肿瘤与其新宿主的共同进化和转移性 TME 的形成。初始转移灶可以促进癌细胞重新编程,以增加对癌细胞对广泛继发转移的适应性,从而导致更高的临床发病率和死亡率。乳腺癌和前列腺癌细胞的体内谱系追踪研究表明,骨微环境不仅为初始转移提供了生态位,而且还诱导了 EZH2 介导的表观遗传,使瘤细胞加速向内脏器官转移,从而产生更严重的肿瘤负荷。
最近的研究通过使用转录组学、蛋白质组学、流式细胞术和空间实验方法,全面研究了原发性和转移性脑肿瘤的 TME。尽管基质细胞的组成相对固定,然而研究者在不同的脑恶性肿瘤中,发现了免疫细胞组成及其表达特征的疾病特异性差异。与脑转移相比,原发性脑肿瘤的淋巴细胞和中性粒细胞浸润较少,而不同的转移性肿瘤中,研究者也发现不同免疫细胞类型的明显富集,这意味着原发性脑肿瘤对 TME 的塑造,与颅外肿瘤转移到大脑的方式不同。这些研究结果,让我们更好地了解在同一解剖位置,不同肿瘤 TME 由不同细胞组成,并间接证明,针对TME 的一刀切治疗方法具有局限性。更重要的是,上述研究还证明“土壤”不是静止的,而是动态变化的。尽管转移器官的稳态生态位,最初可能是相似的,但浸润性癌细胞可以促进 TME 的进化,进而在肿瘤中招募特定免疫细胞细胞,从而促进瘤细胞的转移。
转移性癌症是一种影响所有器官系统的全身性疾病。因此,影响身体营养、代谢、神经激素和炎症状态的全身性因素,均可以影响转移的所有三个阶段。关于肿瘤进展过程中的器官间系统通讯网络相关研究,是目前最前沿的研究课题。原发性肿瘤分泌的因子,可以重新编程骨髓细胞和 ECM,从而创造有利于转移播种和生长的转移前生态位。炎症状态,包括肥胖和衰老,可以促进瘤细胞转移,而运动和健康饮食,可能会降低转移风险。肠道微生物群通过微生物代谢物的直接细胞效应,或通过 TME 的重新编程,从而促进肿瘤的转移。有趣的是,最新研究已发现,细菌可以选择性地定殖于多种癌症表面,包括那些源自非屏障上皮细胞的癌症,这种关联是相关的还是因果关系,目前仍不是很清楚。瘤内梭杆菌定植可驱动乳腺癌细胞的转移,而小鼠乳腺癌 CTC 中的瘤内细菌,可以通过肌动蛋白细胞骨架重塑,促进了瘤细胞对流体剪切应力的抵抗,从而促进了肿瘤的转移。癌症神经科学的新兴领域,揭示了电活动,以及神经-免疫-癌症相互作用在癌症进展中的作用,超越了长期公认的神经周围浸润作用。最近的研究表明,昼夜节律可以控制肿瘤传播的时间,抗肿瘤免疫通过树突状细胞,有节奏地将瘤细胞运输到引流淋巴结。这些研究表明,通过破坏昼夜节律信号通路,或与昼夜节律同步治疗,来靶向治疗肿瘤转移。晚期癌症最显著的表现是恶病质,这是一种分解代谢状态,蛋白质溶解,功能丧失,这与厌食、胰岛素抵抗和脂肪组织丢失有关。恶病质的发生率和严重程度,随着转移而增加,限制治疗的耐受性,可诱导免疫抑制,并与死亡率相关。相关研究者描述了转移过程中肿瘤和微环境重塑是如何诱发恶病质,这可能会产生更有希望的治疗方法,从而对抗转移性癌症。
转移选择的癌细胞,具有动态重新编程能力,以适应不同压力、逃避免疫监视和颠覆宿主组织生物学,以促进肿瘤的远处转移。癌细胞可以具有相同的适应性,以促进瘤细胞对相关治疗的抵抗,并刺激肿瘤的再生(图 2)。转移和治疗抵抗之间的密切关系显而易见,因为全身转移或临床 IV 期疾病,在很大程度上仍然无法治愈,5 年生存率在 5% 到 30% 之间。治疗对转移性癌细胞施加进一步的选择压力,推动选择携带耐药突变的肿瘤亚克隆产生,并诱导炎症信号的产生。转移性疾病的治疗方法,是几乎所有全身性癌症治疗的目标,包括化学疗法、靶向疗法和免疫疗法。癌症患者在以下两种情况下,可以接受全身治疗:(1) 原发性肿瘤可手术切除,且无转移性疾病临床证据的患者(I-III 期),在手术前(新辅助)或手术后(辅助)接受全身治疗,主要目标是消除微转移;(2)具有广泛大转移性疾病的 IV 期癌症患者,治疗通常从治愈,转向姑息治疗和延长生命(图 5 )。虽然化学疗法仍然是药物治疗的支柱,但在过去二十年,随着 ICI、靶向疗法(例如激酶抑制剂)和抗体-药物偶联物(例如 Her2 +乳腺癌)的出现,显着提高了患者总体生存率。研究者对转移原理和机制的新生物学见解,为进一步改善微转移和全身转移癌症的治疗,提供了许多可行策略(图 5 )。
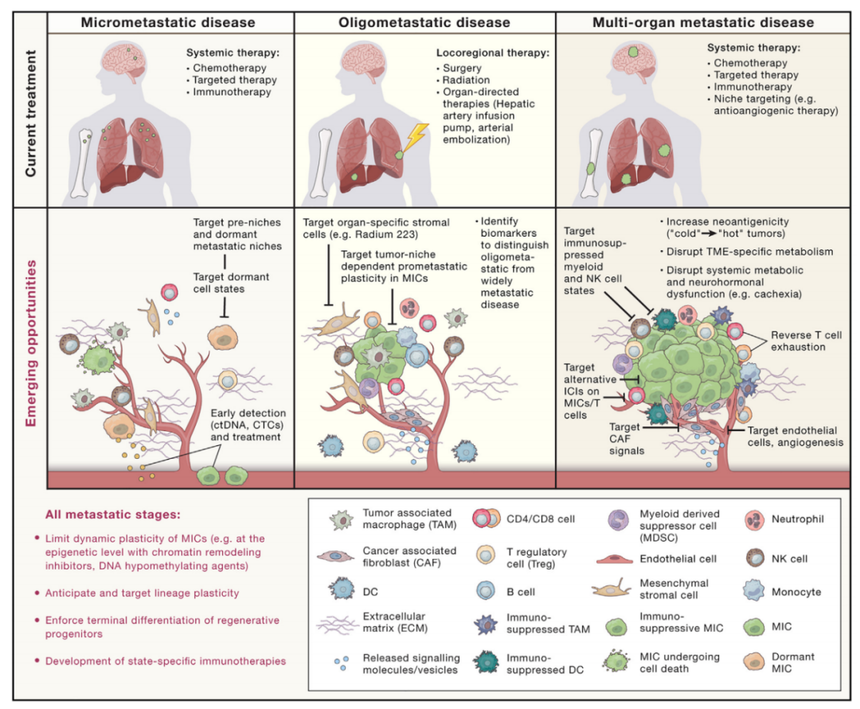
图5.当前和新兴的转移性疾病治疗策略
(A) 转移性疾病在三种情况下进行治疗:当标准成像和筛查技术无法检测到转移性疾病时,在(新)辅助治疗环境中怀疑微转移性疾病。尽管多器官转移在很大程度上是无法治愈的,但对寡转移性疾病进行选择性局部治疗可以延长生命,有时还可以治愈多种癌症。多器官转移性疾病通常采用全身治疗,包括化疗、靶向治疗(例如,小分子抑制剂、抗体或抗体-药物偶联物)和免疫治疗。
(B) 强调了针对癌细胞或其 TME 以最大限度地消除转移细胞的治疗方式的机会。在微转移中,MIC 与免疫监视处于动态平衡。增殖细胞经常被组织驻留或循环免疫细胞消除,而休眠细胞则逃避免疫破坏。在寡转移中,小肿瘤被 TME 驻留细胞浸润并募集免疫细胞。在多器官转移中,TME 变得越来越免疫抑制,排出肿瘤反应性免疫细胞或使它们进入免疫抑制状态。
1、靶向休眠微转移
迄今为止,靶向作用于转移播散介质的药物,例如基质金属蛋白酶抑制剂,尚未在临床试验中取得成功。通常,当检测到原发性肿瘤时,DTC 已经播散到远处的器官,使得阻止DTC传播的药物治疗无效。有研究者指出,改善癌症预后的最大机会,是专注于休眠微转移相关的临床试验(图 5)。随着研究者对休眠状态、可塑性和分子基础的生物学理解不断加深,微转移的标志物、信号通路和免疫逃避策略,正在逐渐应用于肿瘤转移的治疗中。然而,与之相关的临床药物,通常在肿瘤对标准治疗产生耐药,并伴有晚期转移的情况下应用。如果研究者在相关领域取得成功,先在晚期转移的患者群体中推进相关临床实验,然后在高危患者群体中推进预防远处转移的治疗,从而治疗没有临床转移,但转移复发风险高、可能携带微转移的患者。目前的临床相关研究显示,许多可能有效治疗微转移,但不能有效治疗远处转移的药物,患者并不能从其中获益。
快速且经济高效地推进针对微转移的试验的关键要求,是建立休眠微转移疾病的相关生物标志物,以确定最有可能从辅助治疗中获益的患者。在这方面,血液中的“液体活检”ctDNA 检测,是一种很有前景的生物标志物,但需要进一步提高此类检测的敏感性,以及其结果的临床可操作性。另一种识别微转移的潜在方法,是使用骨髓活检来识别DTC。基于转移瘤细胞的单细胞分析、ctDNA 的表观遗传修饰检测,或检测 CTC、外泌体、免疫细胞和细胞因子检测的相关技术发展,可以为预测性实时生物标志物的开发,提供可行策略和技术支持。这些方法的应用,将有助于对患者持续治疗,从而根除微转移性病灶。
2、靶向作用于寡转移
转移可以显示出肿瘤类型的特定生长模式,即缓慢转移,或转移到单个器官部位。寡转移性疾病,目前被定义为转移扩散的中间状态,其中,局部消融疗法,对患者有益。在寡转移情况下,手术切除或放疗,可以减少肿瘤负荷、延长生命,并有可能治愈患者。以手术、放疗和化疗的形式联合治疗寡转移性疾病,目前是软组织肉瘤的标准护理治疗,全身治疗的疗效有限。结直肠肝转移手术切除,可治愈 20% 的患者,并延长转移患者的生存时间(图5)。肝动脉灌注化疗、栓塞和射频消融在内的肝脏定向疗法,已显示出显著的生存获益。最近涉及寡转移性疾病放射治疗的随机对照试验表明,在乳腺癌、前列腺癌、肺癌和其他癌症患者中,经治疗后,无病生存期和总生存期延长。研究者应用镭,选择性地结合到骨转换增加的区域,在对伴有骨转移的晚期转移性前列腺癌患者的治疗中,显著提高了患者的总体生存时间,这表明骨生态位的特异性靶向,可以影响随后的广泛转移,这与在小鼠模型中的观察结果一致。总之,这些研究表明,广泛转移和寡转移性疾病,在临床上具有不同特点。传统观点认为,局部治疗通常不能提高 IV 期癌症患者生存率。目前最新的研究结果,对这一传统观点提出质疑。在出现寡转移的患者中,目前很少有临床指标可以检测,这可能与器官受限的疾病与快速传播的亚临床微转移相关,后者在短时间内可以检测。这两种情况,需要不同的治疗方法,并产生不同的结果。研究者对于相关潜在生物学标记,尚未达成共识。
3、靶向作用晚期转移
晚期转移性疾病的可塑性,对癌症治疗提出了巨大挑战,从理论上讲,动态重编程细胞状态的能力,可以赋予瘤细胞对药物的耐药性。虽然随着肿瘤的单细胞分析的进展,正在对肿瘤异质性认知,产生巨大的影响,但还需要做更多的研究,来确定在具有不同肿瘤和宿主遗传学或生活方式因素的患者之间,适应性程序是否共享,以及共享的程度。传统观点认为,由保守发育或再生程序的共同选择产生的转移介质,可以为治疗提供广泛适用的靶点,而与肿瘤的特异性或亚克隆性无关。然而,由于大量的脱瘤靶向毒性、背景依赖性多效性作用以及这些通路的反馈回路,迄今为止,针对靶向作用于癌症有关的发育信号通路(如 Wnt、TGFβ、Notch 和 Hedgehog)的努力,收效甚微。其它方法侧重于靶向转移性癌症代谢,例如抑制结直肠肝转移中的 SLC6A8 磷酸肌酸转运蛋白,特异性作用TME ,以克服转移特异性免疫抑制环境。目前仍然需要更多的临床前研究,以着重描述癌症特有的发育和再生程序,以及在癌细胞及其进化的 TME 的转移阶段,选择性调节此类通路的分子。这些研究可以提供两条途径来对抗转移。首先,可以描绘可塑性终点状态,从而实现对这些状态的预期目标。其次,抑制可塑性的分子介质。从而限制转移细胞进化空间,使它们对治疗敏感(图 5)。
1、转移和肿瘤发生具有分离的特性
转移历来是癌症进展的最后阶段。即,致癌驱动突变,将正常上皮细胞转变为过度增殖的原发性肿瘤,其中这些肿瘤细胞的部分克隆亚型,获得侵入、传播和定殖远处器官的能力。上述观点认为,正常细胞先变成肿瘤细胞,然后才能变成浸润性癌,从而发生转移。发生转移性疾病的可能性,与原发肿瘤的大小密切相关,这反映在临床 TNM 分期(T,大小肿瘤;N,扩散到区域淋巴结的程度;M,转移的存在),用于选择患者的辅助治疗方法。然而,目前最新的研究结果,正在挑战这一观点。来自导管原位癌和胰腺上皮内瘤变的癌前细胞,可以在没有临床诊断为癌症的患者的血液、骨髓和远处器官中发现。早期播散瘤细胞,是某些癌症晚期转移的主要来源。对小鼠模型的研究表明,致癌转化,不是转移所必需的。未转化的小鼠乳腺上皮细胞,可以在肺中播种,形成形态正常的微集落,并且在癌基因的诱导激活后,长成与原发性乳腺肿瘤的转移无法区分的病变。携带钠通道 NALCN 条件性缺失的小鼠,可以表现出广泛播散且形态正常的细胞,这些细胞没有致癌突变。NALCN 缺陷的未转化细胞,在受体小鼠的肾脏中形成形态正常的复杂结构,例如肾小球。此外,转移细胞通常在组织再生过程中,表达 L1CAM ,这与原发性肿瘤特有的无限制增殖不同。目前仍然需要更多的研究,来证明正常细胞传播到远处器官的程度。然而,这些结果共同表明,转移和肿瘤起始,可以是不同的,且相互合作的过程,不需要遵从严格的时间顺序。在治疗上,这种不断变化的时间范式的重要意义在于,首先,靶向肿瘤起始所需的致癌驱动突变,可能不足以靶向消灭转移细胞;其次,赋予细胞转移能力的介质,应该是肿瘤进展的早期靶点,这适用于高危人群的癌症预防。
2、理解和对抗转移的新兴方法
随着单细胞和空间技术,以及计算系统生物学的发展,研究者不断探索TME 和克隆动力学。越来越多的技术,能够以单细胞和空间分辨率,来分析表观遗传标记、蛋白质和代谢物,并使现有的转录组学技术,适应当前的临床及病理诊断标准。基于 DNA 编辑的高保真诱导谱系研究,允许研究者对细胞状态转换,进行精确的时间排序。在临床样本中,线粒体突变分析和基于液体活检的实时克隆追踪,正在成为热门的研究方法,它们可以描述肿瘤进化过程中亚克隆出现的顺序。随着这些技术进步,癌症生物学的单细胞时代面临越来越大的挑战,首先,这需要可重复和透明的算法,以及受过计算编程训练的研究人员来分析、解释和共享不断增长的“大数据”。其次,验证过程中,需要严格验证肿瘤分析中出现的假设、定义分子机制并将其转化为新疗法的实验方法。在上述验证过程中,需要对复杂的类器官和小鼠模型进行多重工程,以同时诱导多个突变,从而准确模拟肿瘤内和肿瘤间遗传和表观遗传细胞状态的异质性,最终确定共享的调控通路。新兴技术可以更准确地代表患者、疾病阶段和特定部位的 TME,包括患者来源的类器官、免疫共培养物、肿瘤外植体培养物和人源化小鼠,这些技术正在帮助研究者产生新的机制见解,并实现快速药物反应评估。研究者采用离体模型的前瞻性临床试验,作为患者特异性治疗反应的治疗前“化身”,以指导临床决策。最后,人工智能有望改变临床试验设计,以加速生物标志物的发现和药物开发。
总之,转移依赖于多种机制,来参与表观遗传编码的程序,这些程序能够动态适应不断变化的条件、细胞应激、组织生态位外的生存、传播、免疫逃避以及 TME 共同选择和终末器官定植。随着单细胞分析、谱系追踪以及复杂的临床前和离体模型等新技术的出现,现在的挑战是定义转移依赖性,这些依赖性可以针对肿瘤异质性较大的患者。总之,转移研究和临床药物开发领域的重大进展,有可能改善转移性癌症患者的预后。






















