将Transwell小室放入配套培养板中,形成由细胞可穿透性膜分隔开的两室系统,并将高营养液与低营养液分隔开,为进行侵袭实验,在膜上室铺基质胶(用由细胞外基质组成的凝胶堵塞膜中的孔,该凝胶旨在模拟肿瘤细胞在体内侵袭过程中遇到的典型基质),通过将细胞放置在凝胶的一侧,将趋化剂放置在凝胶的另一侧,侵袭细胞将降解邻近基质并迁移通过ECM凝胶(基质降解与定向运动相结合,即侵袭),从而通过计数穿过细胞以检测细胞侵袭能力。
由于Matrigel胶内含有层黏连蛋白、Ⅳ型胶原、纤连蛋白、硫酸肝素糖蛋白、触角蛋白、TGF2β及生长因子等人体ECM的大多数成分,类似动物的基底膜。因此,可模拟最真实的体内环境,体外检测细胞的侵袭性,间接反映体内肿瘤侵袭的能力。
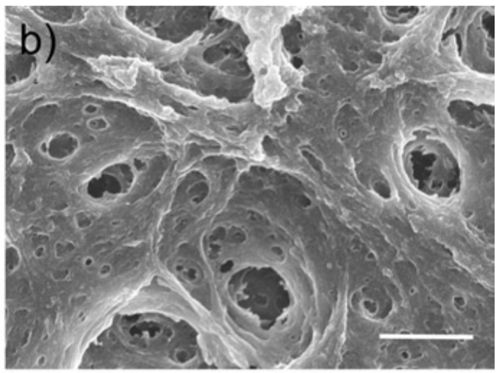
图为100%Matrigel(约3.5 mg/ml)凝胶在Transwell膜上。
请注意,该结构不是纤维蛋白,而是更偏向凝胶样
1. 实验准备
提前12 h将Matrigel放到4℃融化,将实验用到的枪头、EP管等材料提前放到-20℃预冷;实验前准备冰盒,整个实验操作过程置于冰上进行;
2. 包被基底膜
在冰上将Matrigel胶用无血清的细胞培养基进行稀释,混匀后加入小室中,注意动作轻柔,不要产生气泡,将小室放入CO2培养箱中孵育2h备用;
3. 水化基底膜
将孵育完成的小室中上室多余的液体小心吸掉,每孔中加入100 μL无血清培养基,在培养箱中放置30 min。
4. 接种细胞
a. 将状态良好的细胞进行消化,离心,用PBS洗1-2遍,用无血清培养基重悬细胞,调整细胞密度至1-10×105/ml(需要做预实验确定具体的细胞密度);
b. 在下室中加入500μL的含10%FBS的培养基,将小室小心放入24孔板内,在上室中加入细胞悬液100 μL-200 μL,放入培养箱中(需要做预实验确定具体的培养时间)。
5. 固定染色、拍照及计数
a. 到时间点后将小室取出,用PBS清洗小室,用棉签轻柔擦去上室细胞和Matrigel后,用4%多聚甲醛固定或甲醇20 min,将小室适当风干,用0.1%结晶紫染色30 min,PBS清洗3遍,于37℃干燥。
b. 将小室置于显微镜下,随机选取5个视野,拍照并计数。
1. Matrigel使用说明
Matrigel应避免反复冻融,分装时将整瓶Matrigel埋没在碎冰盒中,再将冰盒置于4℃冰箱中,建议放在冰箱靠后的位置,放置过夜,避免使用冰箱门进行解冻,因为其内装物的温度在反复打开时会迅速上升,导致材料过早凝胶化。分装后置于-20℃保存,长期保存可放于-80℃冰箱中;
2. 如何尽量避免增殖对结果的影响
如果在侵袭实验期间发生了大量的增殖,那么计算出的绝对侵袭数据将受到影响。因此,侵袭实验时间越短,增殖对数据的影响就越小。当然,实验中的肿瘤细胞很可能在48或72小时内就会增殖,但如果每个治疗组的增殖量是相似的,允许直接比较治疗组之间的相对侵袭数据;
3. 小室的重复使用
很多实验室会将小室进行重复利用,我们需要在用棉签擦拭时避免用力,避免损伤小室膜,重复利用前应在镜下观察小室膜是否有裂缝。
4. 小室孔径的选择


图:选择的孔径远小于细胞直径,图为8μm孔径














