1、BRCA1+/mut和非携带者的人乳腺组织的单细胞转录组学分析
为了确定人类癌前乳腺的异质基质细胞类型及其与上皮细胞的通信,作者分析了一组来自BRCA1种系变异携带者(BRCA1+/mut;n = 20)和非携带者(n = 33)的非致瘤性乳腺组织,使用scRNA-seq、原位分析和体外、体内功能实验。scRNA-seq共对230,100个细胞进行测序(图1a)。对所有样本进行了联合分析,以识别主要的细胞类型及其标记基因(图1b,c)。在上皮细胞内,鉴定了三种细胞类型,分别对应于基底细胞、luminal 1细胞(26122个细胞)和luminal 2上皮细胞(28045个细胞)。在上皮相关的间质中,发现了三种主要的细胞类型,分别对应于成纤维细胞、内皮细胞和周细胞(图1b)。
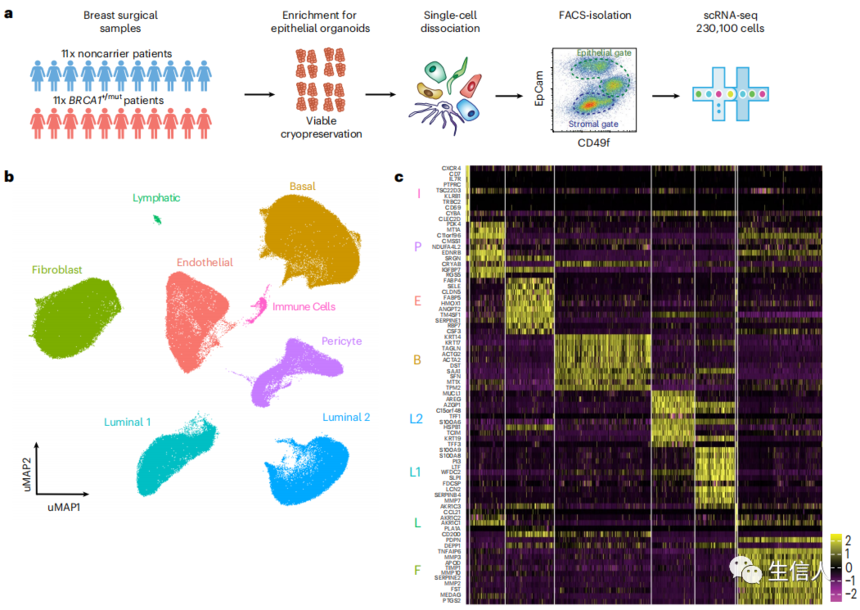
图1
2、BRCA1+/mut乳腺组织中分化改变的管腔上皮祖细胞亚群增殖和积聚增加
先前的研究表明,luminal 1是BRCA1+/mut相关乳腺癌的细胞来源。为了明确癌前BRCA1+/mut组织上皮细胞内的癌前畸变,作者接下来进行了上皮细胞聚类子集,并在细胞状态水平上对所有上皮细胞进行分类,并测定各上皮细胞类型中非携带和BRCA1+/mut之间的差异表达基因(图2a)。为了评估祖细胞的容量,作者使用了一种统计方法,将增加的细胞状态转换概率量化为单细胞能量(scEnergy),如图2b,c所示。在luminal 1细胞中分析基因表达差异,同样显示改变分化的指标,基底标志基因(例如,KRT5,KRT14)和luminal祖细胞基因(例如,ALDH1A3)在BRCA1+/mut luminal 1细胞上调(图2d)。此外,luminal 1细胞显示出基础细胞的基因评分增加,但其他上皮细胞类型相关的基因没有增加(图2e)。原位免疫荧光(IF)证实了这一观察结果(图2f)。同样的luminal 1-aldh1a3阳性细胞亚群也被发现表达高水平的KRT23 mRNA(图2d)。为了在蛋白水平上验证这一发现,作者对从非携带和BRCA1+/mut组织中分离的原代上皮细胞进行了scWB分析,结果显示BRCA1+/mut患者的krt23阳性腔内细胞比例更高(图2g)。接下来,作者在scRNA-seq数据中对上皮细胞进行了细胞周期评分分析,结果显示,在S期,BRCA1+/mut上皮细胞的百分比增加(图2h)。IF染色证实了增殖的上皮细胞数量增加(图2i,j)。综上所述,这些发现表明,BRCA1+/mut的癌前上皮显示出增殖增加和luminal细胞扩张,分化改变,表现为basal-luminal中间表型。
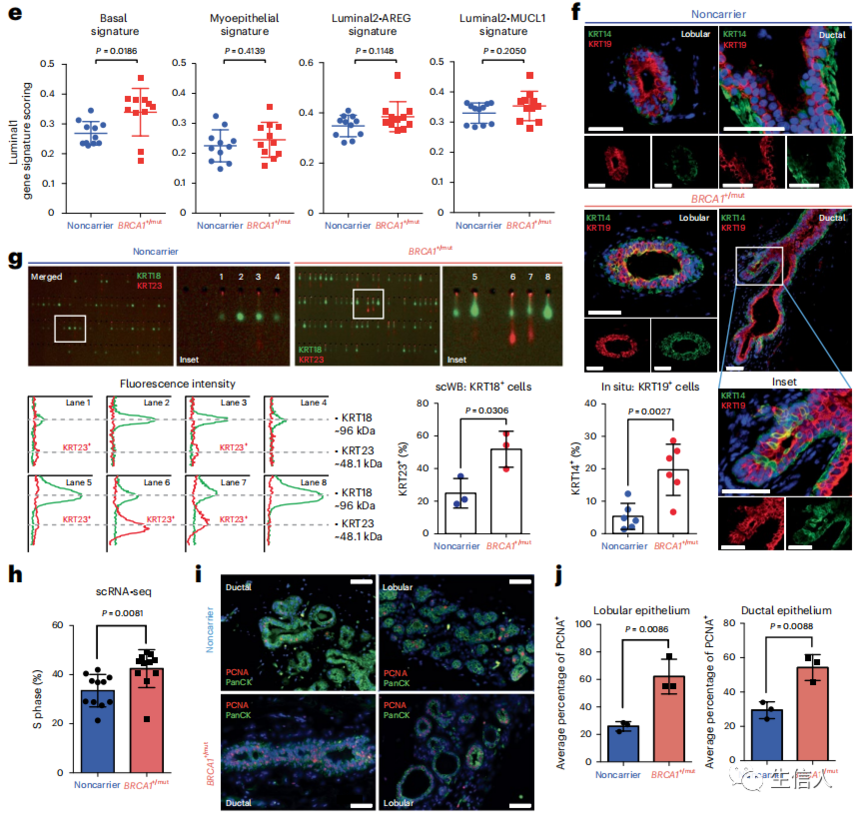
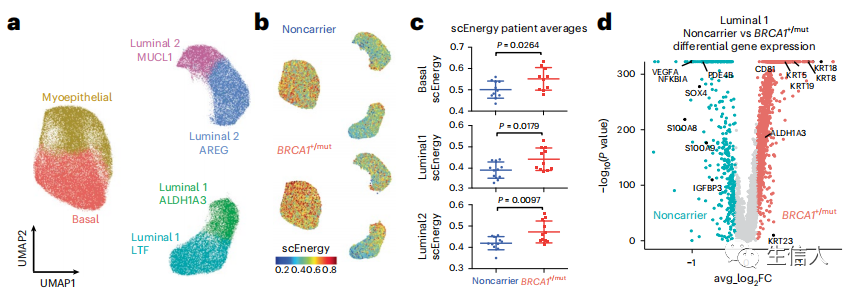
图2
3、BRCA1+/mut乳腺组织中基质细胞诱导的上皮细胞增殖增加
根据分别编码配体和受体的基因的表达,预测非携带者的周细胞和成纤维细胞与上皮细胞进行胶原整合素相互作用,而在BRCA1+/mut中不足(图3a,b)。有趣的是,作者发现了几个编码在BRCA1+/mut中富集的肿瘤促进和增殖诱导生长因子的基因,包括FGF2和来自成纤维细胞的HGF,以及来自周细胞的NGF和INHBA(图3a)。GO分析显示,BRCA1+/mut样本显示来自周细胞和成纤维细胞的促增殖线索总体增加,而内皮细胞诱导丝裂原活化蛋白激酶信号通路增加(图3b),这表明基质生态位的改变驱动了癌前乳腺组织中观察到的上皮细胞增殖。
通过配体-受体分析,作者预测NGF对基底细胞有促增殖作用,流式细胞仪分析支持,只有基底细胞,而不是luminal细胞表达NGFR(图3c)。为了功能性地测试NGF-NGFR的相互作用,在生理相关的ECM水凝胶实验中,NGF的加入显著增加了基底细胞的数量和大小,但没有增加luminal细胞(图3d,e)。这些发现揭示了NGF-NGFR通路作为一种参与肿瘤前BRCA1+/mut乳腺组织中微环境诱导上皮细胞增殖的分子机制。
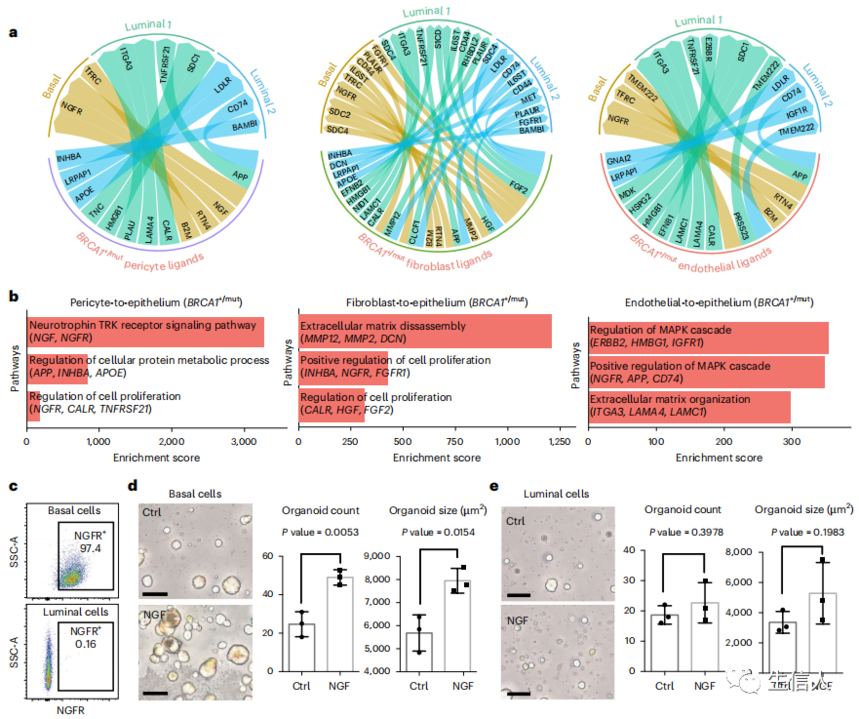
图3
4、癌前BRCA1+/mut乳腺组织中CAF样、表达MMP3的成纤维细胞的扩增
成纤维细胞是关键而丰富的生态位细胞,通过分泌生长因子和ECM分子调节正常乳腺上皮稳态,并作为CAFs促进肿瘤进展。作者对成纤维细胞密度的亚群分析显示,非携带者和BRCA1+/mut组织之间发生了显著变化(图4a),BRCA1+/mut和非携带者成纤维细胞之间的基因表达特征也发生了显著改变(图4b)。基因评分分析显示在BRCA1+/mut成纤维细胞中,CAF和炎症性CAF标志基因的表达升高(图4c),表明BRCA1+/mult成纤维细胞已经在癌前阶段获得了CAF表型(“pre-CAF”表型)。与非携带者相比,pre-CAF表型在BRCA1+/mut队列中显著升高(图4d)。未来的研究需要更详细地分析特定种系BRCA1突变与成纤维细胞和其他基质细胞的细胞状态变化之间的关系。
在所有个体癌症中,编码分泌蛋白酶的基质金属蛋白酶3(MMP3)的基因表达水平是BRCA1+/mut成纤维细胞中最高的pre-CAF标记物之一,这是以前未知的。为了验证MMP3在BRCA1+/mut成纤维细胞中的表达是否在原位蛋白水平上增加,作者对非携带者和BRCA1+/mut样本进行了IF检测。该分析显示,在BRCA1+/mut组织中,MMP3阳性基质细胞靠近上皮结构(图4e,f),表明肿瘤促进MMP3与人类BRCA1+/mut中MMP3与乳腺癌风险增加有直接联系。在BRCA1+/mut中,表达MMP3的pre-CAFs的扩增在小叶区域特别显著,这可能表明BRCA1驱动的肿瘤起始主要发生在小叶区域,而不是导管区域。
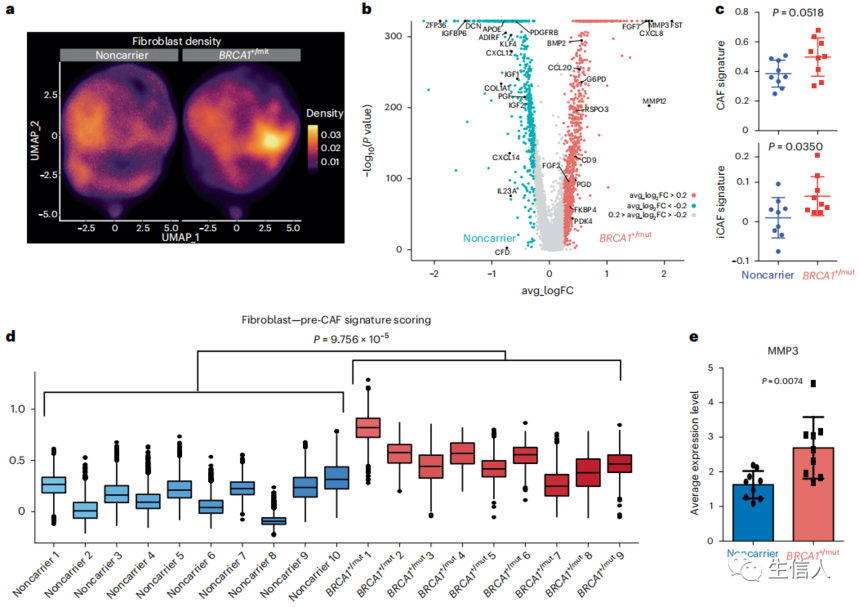

图4
5、MMP3表达的pre-CAFs在体外原代人共培养中促进乳腺上皮细胞增殖和分化改变
为了在功能上确定成纤维细胞来源的MMP3对人乳腺上皮生物学的影响,作者使用原代人乳腺成纤维细胞和乳腺上皮细胞建立了一个3D基质-上皮共培养实验(MECs;图5a,b)。使用慢病毒转导诱导非载体成纤维细胞(+MMP3)中MMP3过表达,在共培养实验中,与对照GFP成纤维细胞(+GFP)相比,MEC生长增加(图5c)。相反,在BRCA1+/mut成纤维细胞(-MMP3)中,使用CRISPR/cas9介导的敲除MMP3会导致乳腺球生长的显著减少(图5d)。为了确定MMP3是否直接促进上皮细胞的生长,接下来将重组MMP3加入到没有成纤维细胞的3D培养的上皮细胞中。结果发现,外源性MMP3足以以浓度依赖性的方式诱导乳腺球生长的增加(图5e)。这些结果表明,成纤维细胞来源的MMP3在反式作用下促进人乳腺上皮细胞的生长。为了确定基质MMP3是否直接诱导分化改变,对MMP3处理的乳腺球上的基础(KRT14)和管腔(KRT19)标记物进行了IF分析,观察到MMP3处理后KRT14/KRT19双阳性细胞显著扩增(图5f)。此外,MMP3可以通过促进典型的Wnt信号通路发挥作用,作者也观察到在MMP3处理过的乳腺球中,Cyclin 1和c-Myc的水平均升高(图5g,h)。综上所述,这些发现强调了MMP3是一个关键的pre-CAFs因子,通过旁分泌相互作用促进BRCA1+/mut中乳腺上皮细胞的分化。
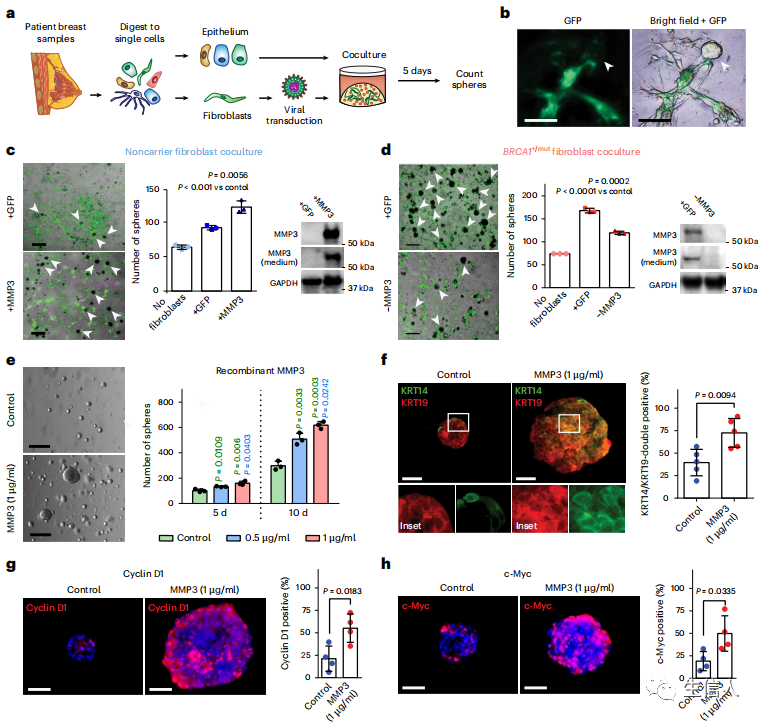
图5
6、MMP3表达的成纤维细胞促进突变BRCA1驱动乳腺癌起始
为了评估成纤维细胞来源的MMP3在体内对肿瘤起始的影响,作者建立了一个由BRCA1驱动的肿瘤起始的成纤维细胞-上皮共移植小鼠模型(图6a)。然后,作者在三个实验组中对免疫缺陷小鼠进行原位乳腺脂肪垫共移植,分组如下:(1)仅乳腺细胞(对照),(2)对照+GFP成纤维细胞和(3)对照+MMP3成纤维细胞。6周后,与对照组相比,+MMP3组和+GFP组的肿瘤起始频率增加,表明成纤维细胞来源的MMP3在体内促进了BRCA1介导的突变肿瘤起始(图6b)。此外,比较肿瘤体积和质量显示,+MMP3组相比于对照组的肿瘤生长显著增加(图6c,d)。这些结果表明,成纤维细胞来源的MMP3在体内以旁分泌的方式驱动BRCA1相关的乳腺肿瘤的发生。
为了进一步证实基质MMP3对上皮细胞分化的影响,作者对MMP3过表达或对照(GFP)成纤维细胞共移植产生的肿瘤进行了原位分析,结果显示,当基质MMP3过表达时,基底(KRT5)和管腔(KRT8)标记物共表达的肿瘤细胞显著增加(图6e)。此外,根据体外乳腺球的结果(图5g,h),在表达MMP3的成纤维细胞存在时,Cyclin D1-和c-Myc阳性的肿瘤细胞数量增加(图6f)。总之,这些结果证实了MMP3在突变BRCA1驱动的乳腺癌起始中的促肿瘤功能,并表明这种改变的分化表型可以通过基质细胞分泌的MMP3以旁分泌方式诱导。

图6
7、基质细胞诱导的上皮细胞增殖导致BRCA1+/mut的终生乳腺癌风险增加
最后,为了评估基质细胞诱导的上皮细胞增殖对BRCA1+/mut患者乳腺癌风险的影响。作者使用一种数学建模方法,模拟肿瘤祖细胞的种群动态,模拟了BRCA1和其他致癌基因(例如p53)的序列突变的发展(图7a)。预测结果显示,双重基质诱导的增殖增加导致了一个潜在的肿瘤祖细胞群体的显著积累(图7b),这与在BRCA1+/mut中发现的basal-luminal中间祖细胞扩张的结果一致(图2e-g)。然后作者使用随机突变模型以假设获得性突变会导致癌细胞适应度的随机变化,预测结果显示,细胞增殖的两倍增加会导致患癌症的总体风险显著增加(图7c)。这表明,基质细胞诱导的上皮细胞增殖可能与BRCA1+/mut中乳腺癌风险的增加直接相关(图7d-f)。




















