2023年8月22号,中南大学生命科学学院李家大课题组在国际权威期刊JCI Insight(中科院1区Top)发表了题为“Cry1Δ11 mutation induces ADHD-like symptoms through hyperactive dopamine D1 receptor signaling”的研究论文,揭示了多动症的发病新机制及治疗新靶点。

ADHD Attention deficit and hyperactivity disorder
多动症,也称作注意力缺陷障碍(Attention deficit and hyperactivity disorder,ADHD),是最常见的神经发育障碍,患病率高达5%。主要包括注意不集中、注意持续时间短暂、活动过度、冲动等临床症状;常导致儿童学习困难,成年后易出现反社会行为、重度抑郁症和焦虑症等精神障碍,对个人、家庭和社会造成了严重的负担。
多动症的病因复杂,涉及遗传、轻微脑损伤、不良的社会和家庭环境等多方面的因素。研究表明多动症的遗传度为0.75-0.91,但是具体的遗传方式和致病机制尚不清楚。
最近的研究表明,昼夜节律基因CRY1的一个突变(CRY1Δ11,全球0.44%的人携带该突变)会导致多动症,但其致病机制尚不明确。在本研究中,李家大课题组构建了Cry1Δ11点突变小鼠,并综合运用行为学、转录组学、免疫组化、电生理、生物化学等实验技术,揭示了Cry1Δ11突变导致多动症的分子病理机制,为多动症的治疗提供了潜在新靶点。
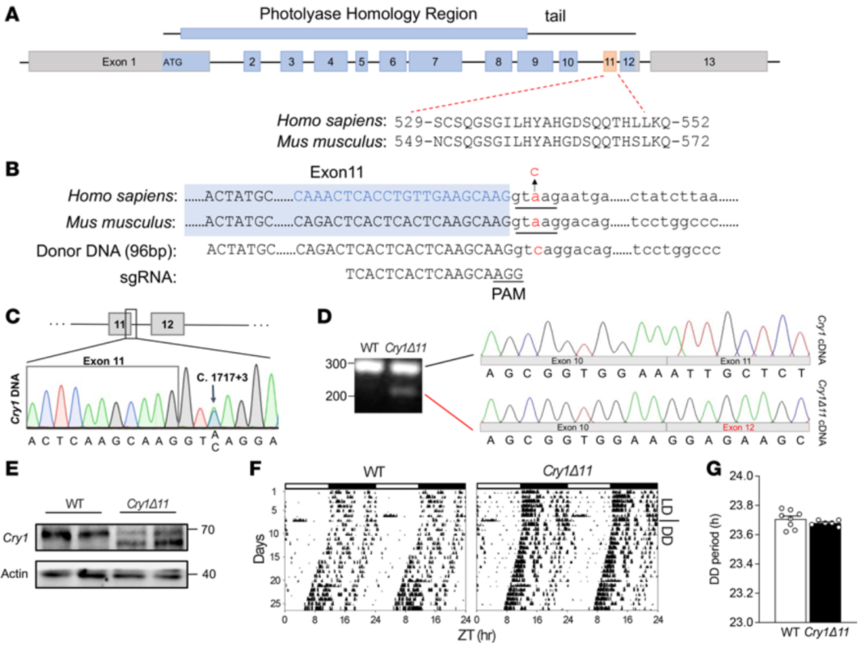
1、CRY1Δ11突变小鼠模型的制备
研究人员基于患者突变信息,成功构建CRY1Δ11突变小鼠。昼夜节律实验表明CRY1Δ11突变小鼠不存在睡眠相关障碍。
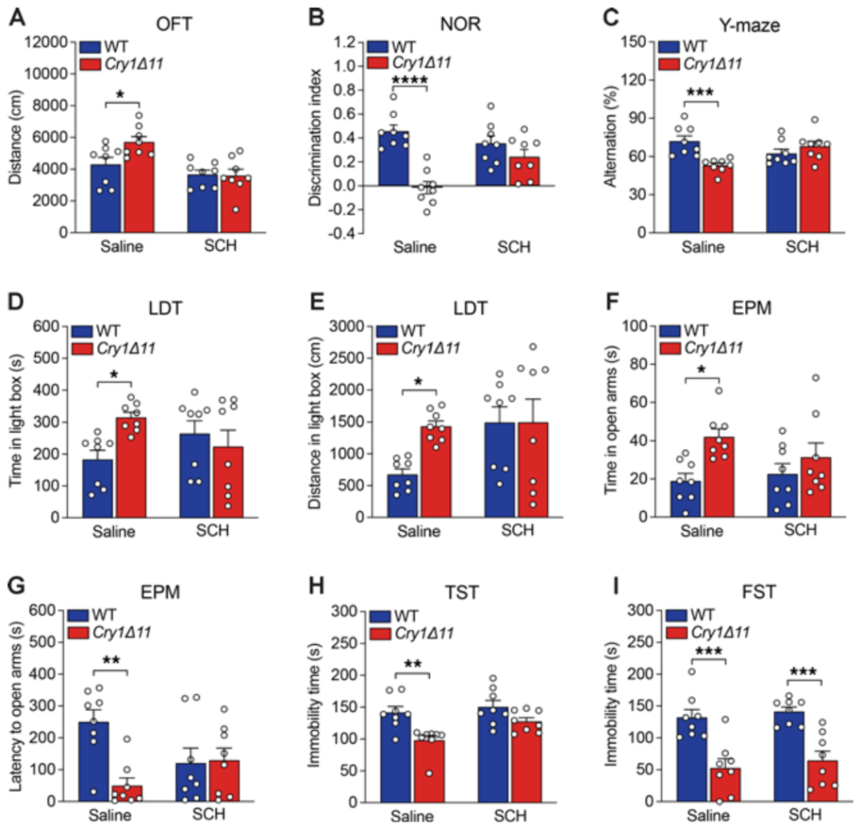
2、CRY1Δ11小鼠存在多动、学习和记忆缺陷
利用旷场、新物体识别等行为学范式检验CRY1Δ11小鼠表型。发现CRY1Δ11小鼠存在多动、学习和记忆缺陷。
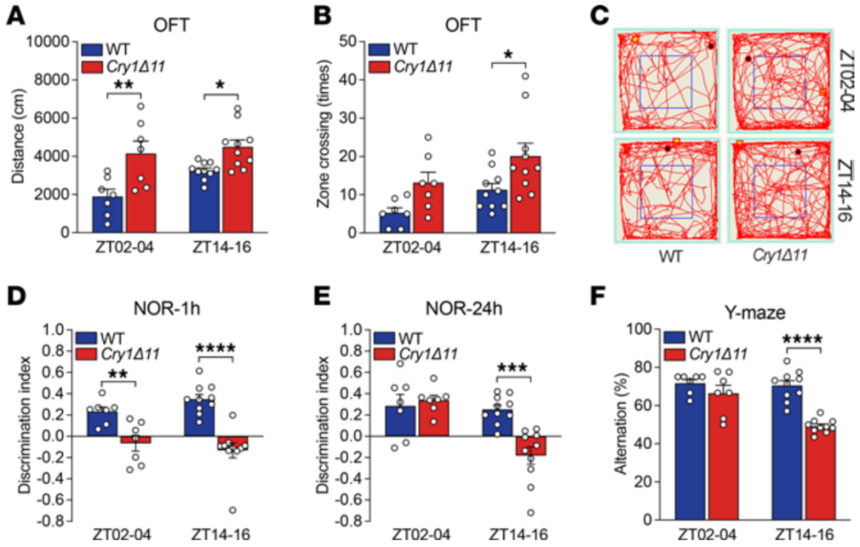
3、CRY1Δ11小鼠存在冲动表型
利用黑白箱、强迫游泳等行为学范式检验CRY1Δ11小鼠行为学表现。发现CRY1Δ11小鼠存在冲动表型。
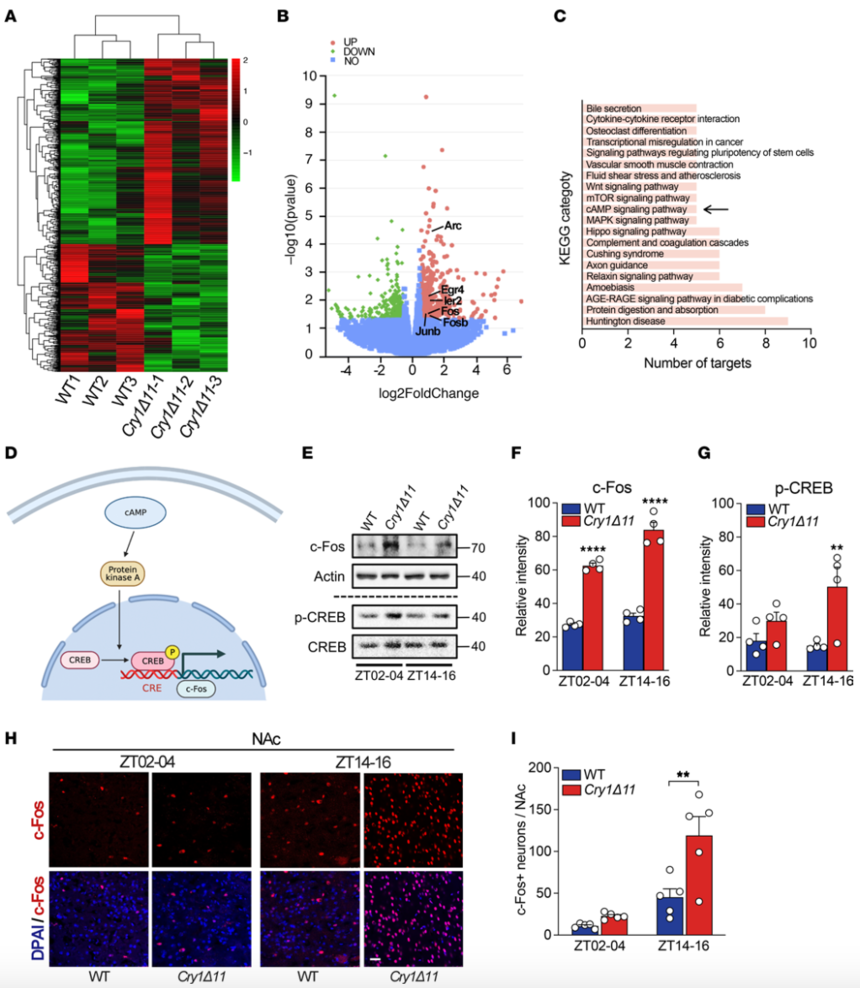
5、CRY1Δ11小鼠NAc脑区DRD1信号异常活化
进一步的神经元共定位和膜片钳电生理研究显示,Cry1Δ11突变导致小鼠NAc脑区多巴胺1型受体(DRD1)神经元异常活化。分子机制研究表明:野生型CRY1可以与Gαs蛋白结合,抑制DRD1的信号转导,而CRY1Δ11突变体失去了该抑制活性,导致DRD1活性异常升高。
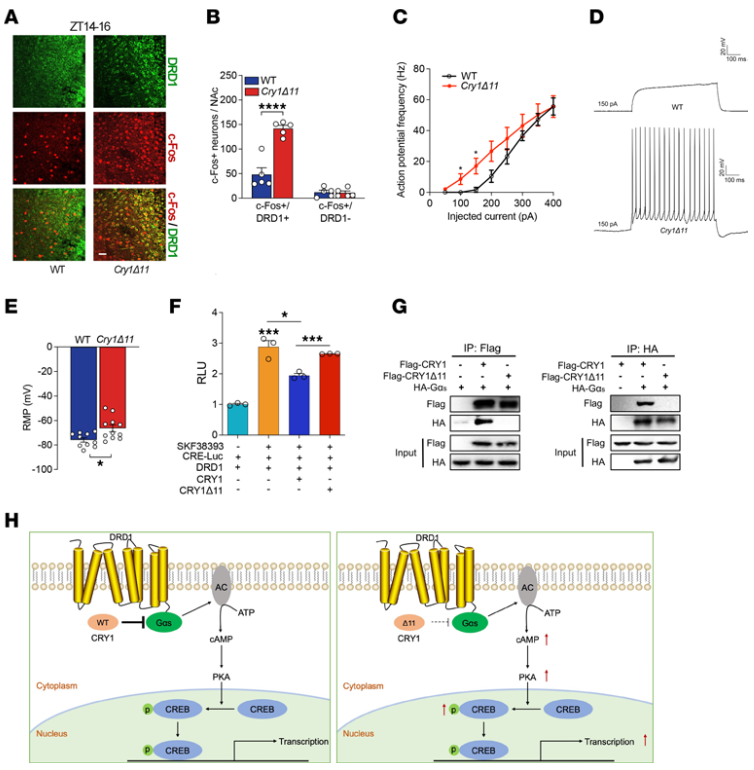
6、DRD1拮抗剂挽救CRY1Δ11小鼠多动症行为
最后,研究人员发现DRD1拮抗剂SCH23390可以完全挽救CRY1Δ11小鼠的多动症行为。进一步证明了异常活化的DRD1信号转导是CRY1Δ11突变导致多动症的分子基础。该研究阐明了CRY1Δ11导致多动症的分子病理机制,促进了对多动症发病机制的认识,有助于新型多动症靶点药物的开发。