目前引物合成基本采用固相亚磷酰胺三酯法。DNA合成仪有很多种, 主要都是由ABI/PE 公司生产,无论采用什么机器合成,合成的原理都相同,主要差别在于合成产率的高低,试剂消耗量的不同和单个循环用时的多少。
亚磷酰胺三酯法合成DNA片段,具有高效、快速的偶联以及起始反应物比较稳定的特点。亚磷酰胺三酯法是将DNA固定在固相载体上完成DNA链的合成的,合成的方向是由待合成引物的3′端向5′端合成的,相邻的核苷酸通过3′→5′磷酸二酯键连接。
通过氨水高温处理,连接在CPG上的引物被切下来,通过OPC, PAGE等手段纯化引物,成品引物用C18浓缩、脱盐,沉淀。沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
◆ 脱盐
寡核苷酸合成后,为了纯化寡核苷酸成为天然的DNA结构,首先必须去除保护基团。通过浓氨水处理,合成的寡核苷酸从固相载体上分离,2-氰乙氧基--磷酸二脂键的保护基团,以及碱基的保护基团基(苯甲酰基和异丁基)被去除,从而形成了天然的DNA结构。然而,必要的去保护步骤完成后,寡核苷酸混合物还包含几种必须被去除的小分子有机化合物。
所有非必须有机化合物被移除的过程通常叫做脱盐。脱盐纯化可以借助反向硅胶柱进行。尽管脱盐纯化可以移除所有的非必须有机杂质,但它不能有效移除合成中产生微量的提前终止的寡核苷酸杂链。然而,脱盐的寡核苷酸还是能够满足PCR检测等基础生物研究。
◆ BioRP / OPC纯化
如果寡核苷酸以“三苯甲基”的形式合成,则N-甲基寡核苷酸包含5’-DMT基团,提前终止的寡核苷酸不包含该基团。因为DMT基有强的亲脂的特性,有5’-DMT基团的寡核苷酸与反相树脂有亲和性,因此反相亲和树脂通常被用于寡核苷酸的纯化。利用反向树脂和5’-DMT寡核苷酸存在强亲和力,但是提前终止的寡核苷酸不包含DMT基团,所以,我们能够成功的把想要的N-甲基寡核苷酸从提前终止的寡核苷酸杂质中分离出来。
◆ HPLC
如果合成的寡核苷酸应用于克隆,定向诱变或定量的基因探测,那么对其纯度要求较高。脱盐或OPC纯化的寡核苷酸可能达不到要求,则HPLC纯化被广泛地用于这个目的。作为一种纯化树脂,阴离子交换树脂或反向树脂被用于寡核苷酸纯化。阴离子交换树脂的HPLC通常显示95-98%纯化效率,对于达到35-mer寡核苷酸的纯化是充分的。反向树脂化的HPLC与阴离子交换树脂的HPLC呈现相似的纯化效率。因为HPLC的纯化效率很大程度依靠寡核苷酸的长度,用HPLC法不能有效纯化长的寡核苷酸(大于35-mer)。
◆ PAGE
对于长的寡核苷酸的纯化(50-100mer),我们推荐PAGE纯化法,它使用交连的聚丙烯酰胺凝胶(电泳)作为纯化基质。尽管PAGE显示出高的纯化效率(>98%),但它在额外的步骤方面有一些缺陷,比如在PAGE之后需要提取和脱盐,继而将导致纯化产率的下降。
答:引物合成引物OD数是这样测定的:用紫外分光光度计,波长260nm,石英比色杯,光程为1厘米,测定溶液的光密度。测定时溶液的光密度最好稀释到0.2-1.0之间。DNA干粉用一定体积的水充分振荡溶解以后,用1ml水稀释测OD值。需要根据稀释倍数换算出母液的OD值。
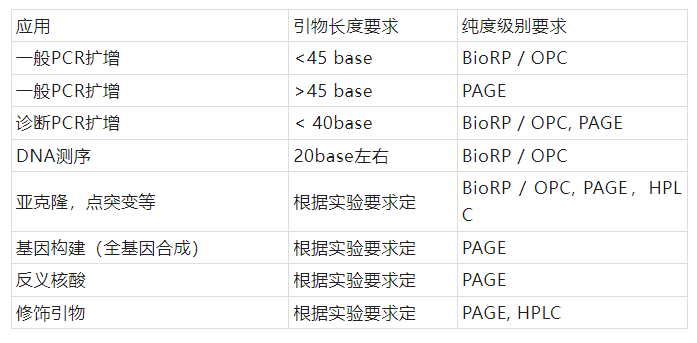
答:引物常用的纯化方式脱盐、BioRP / OPC纯化、PAGE纯化、HPLC纯化。根据实验需要,确定订购引物的纯度级别。
答:引物越长,出现问题的概率就越大。有的公司合成过120base的引物,产率很低。除非需要,建议合成片段长度不要超过80mer,按照目前的引物合成效率,80mer的粗产品,全长(还不一定正确)引物的百分比不会超过40%,后续处理还有丢失很多,最后的产量很低。
答:根据实验目的确定。一般PCR扩增,2OD引物,可以做200-500次50ul标准PCR反应。如果是做基因拼接或退火后做连接,1OD就足够了。但是有些研究人员,就做几次PCR,但是却要5-10OD。
做全基因构建的引物都比较长,但是我们有些研究人员也要求高OD数。片段越长, 最后全长得率就越低,出错的几率就越大。超出需要之外的OD数要求,其实也是对社会资源的一种浪费,同时也从一个侧面反映了部分研究人员特别是新手的自信心不足,总觉得需要重复多次才能成功。
答:实验室方便的作法是用PAGE方法。使用加有7M尿素的16%的聚丙烯酰胺凝胶进行电泳。取0.2-0.5OD的引物,用尿素饱和液溶解或引物溶液中加入尿素干粉直到饱和,上样前加热变性(95℃,2mins)。加入尿素的目的一是变性,二是增加样品比重,容易加样。
600V电压进行电泳,一定时间后(约2-3小时),剥胶,用荧光TLC板在紫外灯下检测带型,在主带之下没有杂带,说明纯度是好的。如果条件许可,也可以用EB 染色或银染方式染色。
答:干燥后的引物质地非常疏松,开盖前最好离心一下,或管垂直向上在桌面上敲敲,将引物粉末收集到管底。根据计算出的体积加入去离子无菌水或10mM Tris pH7.5缓冲液,室温放置几分钟,振荡助溶,离心将溶液收集到管底。溶解引物用的水一般不要用蒸馏水,因为有些蒸馏水的pH值比较低(pH4-5),引物在这种条件下不稳定。
答:引物合成后,经过一系列处理和纯化步骤,旋转干燥而成片状物质。引物在溶解前,室温状态下可以长期保存。溶解后的引物-20度可以长期保存。如果对实验的重复性要求较高,合成的OD数较大,建议分装,避免反复冻融。修饰荧光引物需要避光保存。
答:合成的引物5' 为羟基,没有磷酸基团。如果需要您可以用多核苷酸激酶进行5′端磷酸化,或者要求引物合成公司合成时直接在5′或3′端进行磷酸化,需要另外收费。
连接反应需要引物的5’磷酸基团。如果需要将合成的引物退火直接连接相应的载体上,引物需要磷酸化。磷酸化的产物如果还不能连接载体上,需要检查载体的酶切效果,需要改善引物退火的条件。SiRNA分子具有特殊的对称结构,退火的难度较大,退火时需要提高退火温度。
答:测序发现引物区域有突变,特别是40个碱基以下的引物, 发生的概率不大,但是肯定也会发生。用户一般可以放心,引物序列一般都是通过电脑直接将您的序列COPY到合成仪的,碱基输错的机会不多。核酸合成公司一般会有一套控制办法,预防碱基输入错误。发生这种突变的原因有很多解释,人们还没有办法彻底解决这个问题。引物合成的固相合成原理都一样,采用的机器也基本相同,合成主要原料都是由可数的几家跨国公司提供的,所有每个合成服务商遇到的问题也基本类似,没有人可以超脱。
引物合成是一种多步骤的化学反应,合成效率最高也就是99%,副产品不可以避免。引物合成过程中,造成碱基插入,缺失,置换突变的因素客观存在,有不少降低发生的频率建议和措施,但是这些措施还停留在实验室阶段,还没有能够应用到规模化生产中。
答:引物合成时,每一步反应效率都不能达到100%,产生碱基插入、缺失、置换突变的因素客观条件都有一直存在。引物链越长,突变的频率累加起来就越高。研究人员总希望合成的引物万无一失,这种心情可以理解。
但是犹如PCR扩增,不可能绝对保证扩增产物中没有突变,引物合成也不可能保证100%正确。要知道,引物合成中发生错误(非人为因素)的频率,比任何高保真高温聚合酶PCR扩增过程所产生的频率都要高。做引物合成,长链引物合成,您要有引物中部分引物可能有突变的思想准备。
答:遇到这种情况,首先和核酸合成厂家取得联系,生产人员会检查生产的原始记录,主要是核对合成序列是否和定单一致,他们在电脑中一般会保留所有原始数据。在确认引物合成序列没有输错的情况下,建议重新挑取克隆测序,可能会找到正确克隆的。
根据经验,40个碱基以下的引物,测1-2个克隆就可以了;40个以上的特别是用于全片段拼接合成的,就需要多测一些了。一般情况下,每个克隆突变的位点都不一样,提示正确的总是有的,就是如何找到它。也可以要求公司将引物免费重合一次,不过重合的引物和第一次的引物一样,都可能含突变,不会因为重合的引物就减少您的遇到问题的几率。基因拼接过程中,如果发现一段区域突变点不多,就多测几个,否则就重合一下引物。
15.引物是经过PAGE纯化的,
为什么还有碱基缺失或插入?
答:理论上分析型PAGE变性电泳,可以区分引物之间一个碱基的差别。但是制备PAGE电泳,上样量都是非常大,电泳时的条带非常宽,带与带之间有重叠,分辨率已下降,电泳后割带回收目的引物时,很难说不割到差别仅几个碱基的引物。国内有一个不好的现象,PAGE纯化的引物,特别是长引物要的量都比较高,导致割的条带有时可能比较宽。建议:您如果减少OD数,引物遇到的问题可能就会少一些。
◆TaqMan 探针位置尽可能靠近扩增引物(扩增产物50-150bp),但不能与引物重叠。
◆长度一般为18-40mer 。
◆G-C含量控制在40-80%左右。
◆避免连续相同碱基的出现,特别是要避免GGGG或更多G出现。
◆在引物的5'端避免使用G。
◆选用比较多的碱基C。
◆退火温度Tm控制在 68-70℃左右。
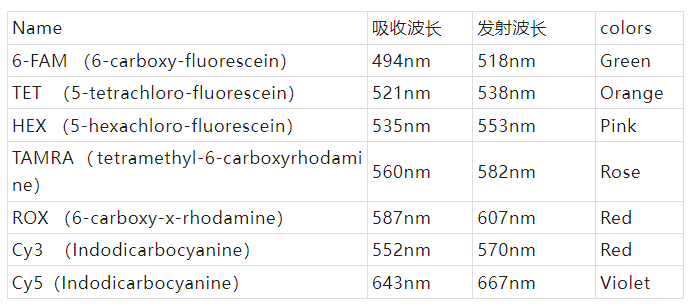
有用的荧光染料参数
◆引物长度一般在18-35mer。
◆G-C含量控制在40-60%左右。
◆避免近3' 端有酶切位点或发夹结构。
◆如果可能避免在3'端最后5个碱基有2个以上的G或C。
◆如果可能避免在3'端最后1个碱基为A。
◆避免连续相同碱基的出现,特别是要避免GGGG或更多G出现。
◆退火温度Tm控制在58-60℃左右。
◆如果是设计点突变引物,突变点应尽可能在引物的中间。
18.为什么引物的OD260/OD280小于1.5 ?
答:引物应该全是DNA,但是OD260/OD280的比值为什么那么低,怎么会有蛋白质污染?引物化学合成,哪里有机会污染到蛋白质?需要指出的是OD260/OD280的比值不能用来衡量引物的纯度。
OD260/OD280的比值过低一般是由于引物中C/T 的含量比较高所致。下表是一个20mer 同聚体引物的OD260/OD280的比值,清楚表明OD260/OD280的比值与引物的碱基组成密切相关。

19.同样的OD用PAGE检测,
EB染色为什么深浅不一?
答:通常可以用EB染色的方法来判断双链DNA的量(如质粒DNA),因为EB可以嵌合到双链DNA中。而合成的单链DNA,由于碱基组成不同,形成二级结构的可能性不同,EB的染色程度也会有差异,比如Oligo(dT)等不形成二级结构,EB染色效果就非常差。所以不要用EB染色的方法来定量,而用紫外分光光度计检测。
答:引物不纯可能会导致:
1)非特异性扩增;
2)无法用预先设计在引物5′端酶切位点的酶切开,特别是没有保护碱基的引物;
3) 用于测序出现双峰或乱峰。解决办法重新合成或重新纯化。
21.已经溶解的引物,为什么原先使用正常,
而过一段时间再使用就不好了?
答:如果溶解引物的水PH过低或污染了菌或核酸酶,会使引物降解。使用时没有充分解冻混合,液体不均匀也可能会造成引物加入量不准确。建议分装引物,避免反复冻溶。建议使用10mMT ris pH7.5缓冲液溶解引物,因为有些蒸馏水的pH值比较低(pH4-5), 引物在这种条件下不稳定。还有一种可能性是引物没有问题,而是PCR使用材料特别是模板的质量与先前使用的不完全一致。
答:基本不是。当今发展出各色各样的PCR扩增技术,各色各样的高温聚合酶,就是来解决PCR扩增中遇到的扩不出、扩增效率低的问题。如巢式PCR就是扩增那些拷贝数很低的基因片段。有些重复片段的扩增, GC含量高的片段,非要采用特殊扩增手段才能扩增出了。
引物扩增不出,主要是下列两种情况比较常见:
(1)RT-PCR。请注意,很多基因通过常规RT -PCR方法是很难扩增出来的。RT- PCR成功的关键在于RT的反应的RNA质量和目标基因在特定组织和细胞中含量。
(2)从基因组中扩增。一般情况下,基因在基因组中都是单拷贝,基因组作为模板需要严格控制用量。基因组DNA过高,会影响反应体系中的Mg和pH。














