|
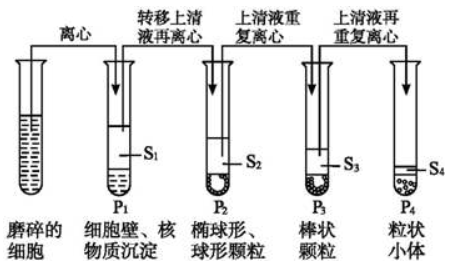
细胞器内蛋白质的制备在生物体内,细胞区隔化使得不同的细胞器拥有各自的蛋白质系统。细胞器是一种动态的结构,如内质网、细胞核和高尔基体等,其组成蛋白质中,除了驻留蛋白质之外,还包括穿梭蛋白质和瞬间相互作用的蛋白质。随着近年来分子生物学、分子遗传学、遗传工程等学科的发展,对各种细胞器所包含的生物大分子,如核酸、蛋白质等的研究工作日益增多,分离各种细胞器上的各类特异性蛋白质已成为生物大分子制备工作的重要内容,掌握这些蛋白质的特异性有助于了解其特定功能,并对细胞器的功能作深入的阐述,同时还可获得细胞器蛋白质的定位信息,有助于进一步认识亚细胞器蛋白质组。 根据实验需要来制备某种生物大分子时,通常先破碎细胞后,再分离细胞器,最后采用相应方法获得需要的生物大分子组分。 1、细胞的破碎 分离亚细胞组分的第一步是细胞破碎,实验中多采用比较温和的破碎方法,且可用显微镜监控以确保细胞器的结构完整。较多采用的是制备组织匀浆或细胞匀浆的方法。匀浆(homogenization)是在低温条件下,将组织或细胞放在匀浆器中加入等渗匀浆介质(即0. 25 mol/L蔗糖及0. 003 mol/L氯化钙溶液)研磨,使细胞被机械地研碎成各种亚细胞组分和内容物的混合液。 2、亚细胞组分的分离 亚细胞组分的分离需要采用分级分离方式,主要是利用由低速到高速的离心技术,使非均一混合体中的颗粒按其大小和密度不同分批沉降到离心管的不同部位,再分部收集,即可得到各种亚细胞组分。由于样品中各种大小和密度不同的颗粒在离心开始时均匀分布于整个离心管中,故每级分离得到的第一次沉淀必然不是纯的最重的颗粒,须经反复悬浮和离心加以纯化。分离亚细胞组分主要的离心技术是差速离心和密度梯度离心。 (1)差速离心(differential centrifugation) 在密度均一的介质中由低速到高速逐级离心,用于分离不同大小的细胞和细胞器。在差速离心中细胞器沉降的顺序一般依次为:细胞核、线粒体、溶酶体与过氧化物酶体、高尔基体与内质网,最后为核蛋白体。 由于各种细胞器在大小和密度上相互重叠,而且某些慢沉降颗粒常常被快沉降颗粒裹到沉淀块中,一般需要重复2-3次才能获得比较理想的效果。通过差速离心初步分离的细胞器,常需通过密度梯离心进一步分离纯化。
差速离心图解 (2)密度梯度离心(density gradient centrifugation) 用一定的介质在离心管内形成一连续或不连续的密度梯度,将细胞的混悬液或匀浆置于介质的顶部,通过重力或离心力的作用使细胞分层、分离。 在实际操作中,一般是将差速离心与密度梯度离心联用,即匀浆产生的细胞裂解物通过一系列差速离心步骤加密度梯度离心来分离细胞器等颗粒。 3、亚细胞组分的分析确认 分离亚细胞组分的第三步是对分离得到的组分进行分析、确认。常用的分析 方法包括形态和功能的鉴定。 4、注意事项及建议 (1)在细胞器的提取过程中,要制定针对不同细胞器的提取方案,提取过程中注意保证其完整性,并在提取结束时先进行细胞器完整性的检验。 (2)细胞器的提取中引入的试剂可能会影响到后续的蛋白质提取等实验,需要在方案设计时一并考虑。 (3)蛋白质提取过程中需要注意对蛋白质的保护,有些蛋白质易被降解,可添加蛋白酶抑制剂、还原剂等,并尽量保持在低温条件下操作。 |