|
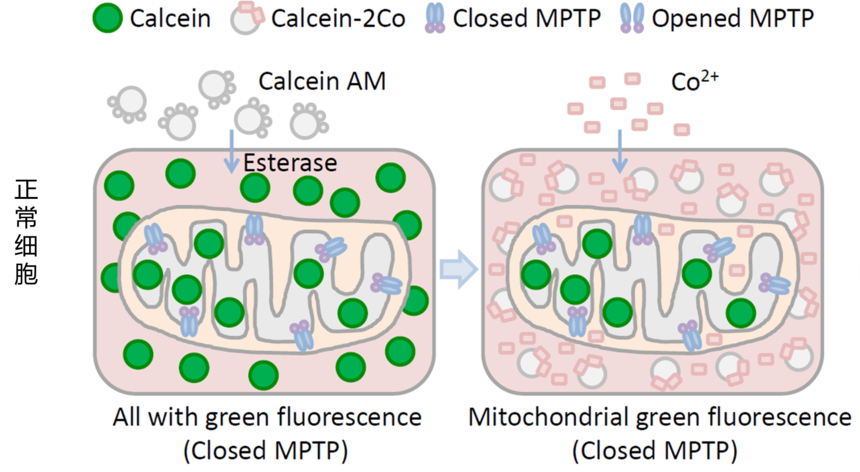
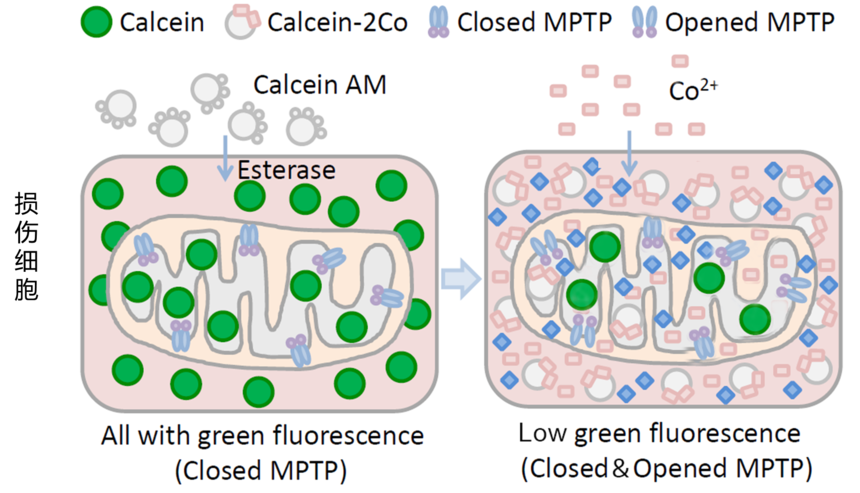
流式与线粒体—MPTP开放检测线粒体是细胞生命活动的重要组成部分,素有“动力工厂”之称,是能量代谢的主要场所,同时也是对各种损伤最为敏感的细胞器之一。线粒体的结构损伤主要表现为肿胀、膜损伤和嵴断裂;功能损伤主要表现为MPTP开放,引起 丧失及CytC和AIF释放等,同时产生ROS,最终导致细胞凋亡。下面我们来介绍一下流式细胞术检测MPTP的开放情况。 线粒体膜通透性转换孔(mitochondrial permeablity transition pore,mPTP),线粒体巨型通道(magachannel),是存在于线粒体内外膜之间的一类蛋白复合体,由多种蛋白亚基组成,是存在于线粒体内外膜之间的一种高非特异性导电性通道。MPTP与细胞的生存、凋亡密切相关,对于MPTP的检测也渗透于缺血 / 再灌注、肿瘤、衰老、神经变性等多个领域。
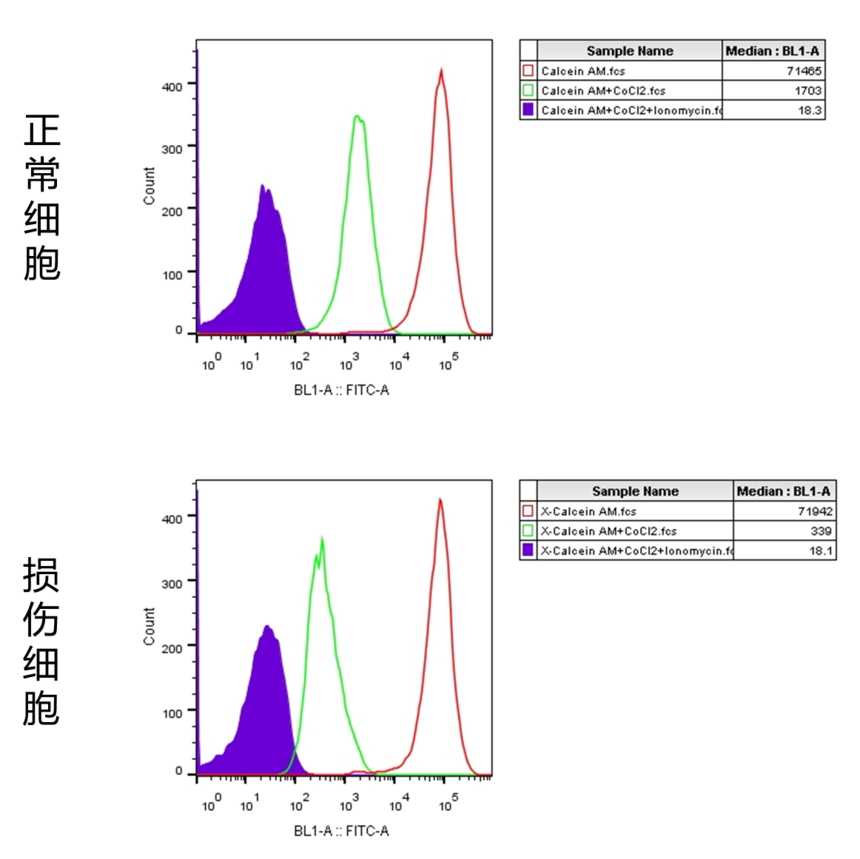
【检测原理】 正常情况下线粒体内会维持较高的Ca2+浓度,以利于肌肉的正常兴奋、收缩和舒张,减少胞浆中Ca2+浓度升高对骨骼肌超微结构的破坏,同时也是敏感性线粒体酶(丙酮酸脱氢酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶)发挥功能所必需的。 大多数的线粒体会与内质网有一个接触点,并建立有稳固的连接。有研究表明内质网中Ca2+释放后一部分进入胞浆引起胞浆内Ca2+浓度升高,一部分会被临近的线粒体募集吸收,此时低电导渗透性转换孔在张开和闭合中来回切换。当细胞受到损伤时,低电导渗透性转换孔渗透性发生改变,Ca2+ 过载,导致MPTP激活。 此时向该细胞中加入荧光探针——钙黄绿素乙酰甲酯(calcein acetoxymethyl ester, 即Calcein AM;一种非极性染料,可以对活细胞进行荧光染色。Calcein AM通过被动运输进入细胞内并在细胞质组分包括线粒体等中积累。Calcein AM在细胞内能被酯酶水解去除乙酰甲酯,生成没有膜通透性的极性荧光染料钙黄绿素(Calcein or Fluorexon),从而使Calcein滞留在细胞内以及线粒体中,使得细胞质包括线粒体等呈现强绿色荧光)。再加入CoCl2用于淬灭细胞质中Calcein的绿色荧光。正常情况下线粒体的MPTP是关闭的,CoCl2不能进入线粒体,因此在正常细胞中只是胞浆中的Calcein被淬灭;但是损伤的细胞MPTP有一定程度的开放,此时CoCl2便可以进入线粒体,因此在损伤细胞中除了胞浆中的所有Calcein被淬灭外,线粒体中的Calcein也有不同程度的淬灭。此时我们可以通过流式细胞仪检测Calcein的绿色荧光信号,通过比较荧光信号的强度判断MPTP的开放程度,进而推断线粒体的损伤程度。 【检测流程】 以线粒体通透性转换孔(MPTP)检测试剂盒操作步骤为例: a.贴壁细胞胰酶消化后用培养液重悬、悬浮细胞直接使用,计数,取适量细胞1000g室温离心5min,弃上清,加入适当体积的检测缓冲液、Calcein AM染色液、荧光淬灭工作液或Ionomycin对照重悬,使细胞为单细胞悬液,并且细胞密度为1×106/ml,每个样品体积为1ml。注:需要准备好仅含检测缓冲液的细胞样品用作流式细胞仪检测时的阴性对照。 b.37℃避光孵育30min。 c.孵育完成后,1000g室温离心5min收集细胞。每个样品加入1ml检测缓冲液,轻轻重悬,1000g室温离心5min收集细胞。 d.用400μl检测缓冲液重悬细胞。 注意整个过程均需避光操作。染色后,将样品置于冰上,可以在1小时内进行流式细胞仪检测和分析。 e.注意使用仅含检测缓冲液的并且未经染色的细胞样品用于流式细胞仪的阴性对照设置。Calcein的最大激发光波长为494nm,最大发射光波长为517nm 【结果展示】
FLOWJO分析结果显示,正常细胞MFI值为:1703,损伤细胞MFI值为:339。损伤细胞荧光强度明显低于正常细胞。 |